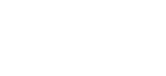体外诊断(IVD,In-Vitro Diagnostics)指将血液、体液、组织等样本从人体中取出,使用体外检测试剂、试剂盒、校准物、质控物等对样本进行检测与校验,以便对疾病进行预防、诊断、治疗检测、后期观察、健康评价、遗传疾病预测等的过程。体外诊断按检测原理或检测方法分类,主要分为生化诊断、免疫诊断、分子诊断、微生物诊断、尿液诊断、凝血类诊断、血液和流式细胞诊断等诊断方法。IVD主要产品包括诊断仪器和诊断试剂两类。
IVD行业属于医疗器械行业的细分子行业,随着近年来我国医疗器械市场的高速增长,IVD行业也涌现了大批高速成长的企业,较为突出的上市公司包括:硕世生物、艾德生物、普门科技、华大基因、透景生命、迈瑞医疗等。我们对近年来登陆A股的IVD企业于IPO申请过程中的审核/问询情况进行了梳理和分析,尝试提炼出中国证监会或上海证券交易所(以下简称“上交所”、“交易所”)所关注的IVD行业重点法律问题,供读者参考。
一、IVD行业IPO概览
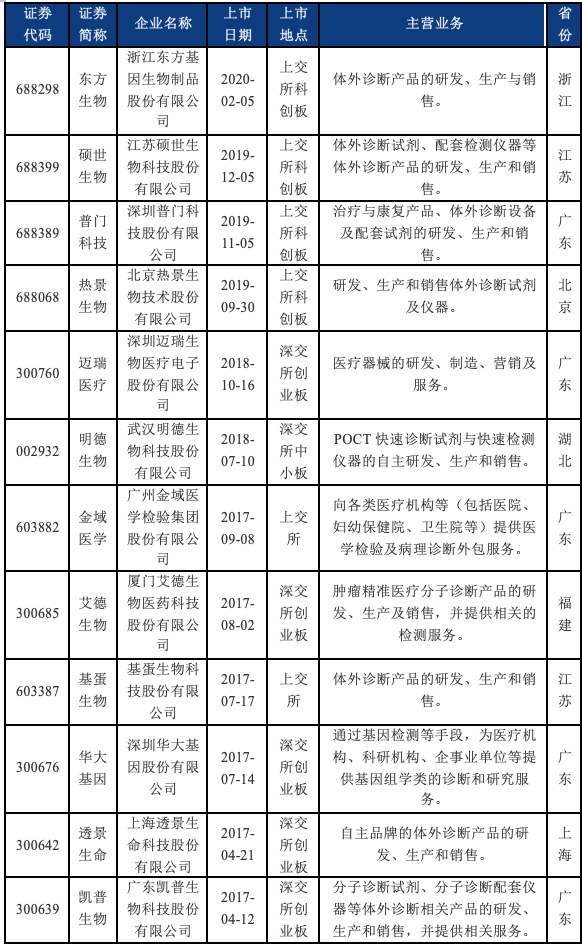
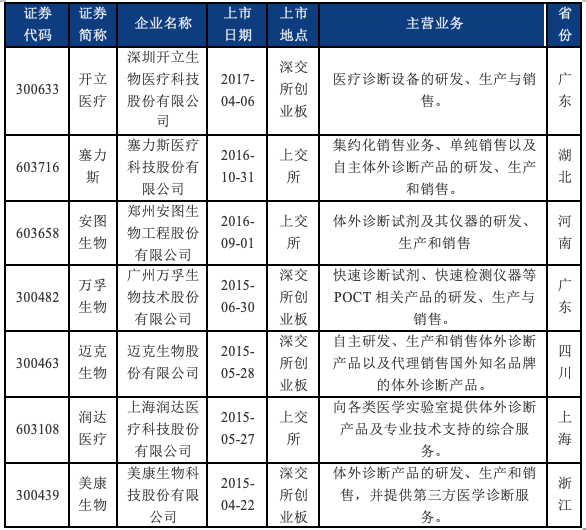
(一)近五年IVD行业上市企业情况
我们梳理了近五年来于境内IPO的IVD企业的基本情况。可以看到,2019年至今新上市的IVD企业均选择了于科创板上市,这也与IVD行业技术属性较强的特点相符。根据我们的检索结果,截至目前,科创板在审IVD企业还包括深圳市亚辉龙生物科技股份有限公司、广州安必平医药科技股份有限公司、北京赛科希德科技股份有限公司、圣湘生物科技股份有限公司、江苏浩欧博生物医药股份有限公司等。
近五年于境内IPO的IVD企业基本情况如下:
(点击可放大查看)
(二)IVD企业科创板上市标准选择
根据《上海证券交易所科创板股票上市规则》,企业申请于科创板上市,市值及财务指标应当至少符合下列标准中的一项:
“(一)预计市值不低于人民币10亿元,最近两年净利润均为正且累计净利润不低于人民币5000万元,或者预计市值不低于人民币10亿元,最近一年净利润为正且营业收入不低于人民币1亿元;
(二)预计市值不低于人民币15亿元,最近一年营业收入不低于人民币2亿元,且最近三年累计研发投入占最近三年累计营业收入的比例不低于15%;
(三)预计市值不低于人民币20亿元,最近一年营业收入不低于人民币3亿元,且最近三年经营活动产生的现金流量净额累计不低于人民币1亿元;
(四)预计市值不低于人民币30亿元,且最近一年营业收入不低于人民币3亿元;
(五)预计市值不低于人民币40亿元,主要业务或产品需经国家有关部门批准,市场空间大,目前已取得阶段性成果。医药行业企业需至少有一项核心产品获准开展二期临床试验,其他符合科创板定位的企业需具备明显的技术优势并满足相应条件。”
根据已于科创板上市的东方生物、硕世生物、普门科技、热景生物等上市公司的招股说明书,并经检索科创板排队中的IVD企业预披露招股说明书,以上IVD企业均选择了前述五项上市标准中的第一项,即:“预计市值不低于人民币10亿元,最近两年净利润均为正且累计净利润不低于人民币5000万元,或者预计市值不低于人民币10亿元,最近一年净利润为正且营业收入不低于人民币1亿元”。
二、IVD行业IPO重点关注法律问题
(一)业务经营合规性
1. 业务资质
医疗器械与生命健康安全息息相关,因此从企业开展运营,到具体产品本身,均存在严格的资质要求。从行政监管角度而言,诊断仪器按照医疗器械进行管理,除国家用于血源筛查和采用放射性核素标记的体外诊断试剂外,其余体外诊断试剂按照医疗器械管理。作为强监管行业,国家对医疗器械实行严格的管理制度,包括分类管理制度、生产许可(备案)制度、经营许可(备案)制度、产品生产注册(备案)制度。以下为IVD企业根据相应的管理制度,可能涉及的医疗器械及医疗机构相关基本资质:
|
序号 |
资质 |
对应事项 |
主要规定 |
|
1 |
医疗器械生产许可证/备案 |
医疗器械生产企业资质 |
《医疗器械生产监督管理办法》、《医疗器械经营监督管理办法》、《医疗器械注册管理办法》、《医疗器械监督管理条例》 |
|
2 |
医疗器械注册证书/备案 |
特定产品生产上市 |
|
|
3 |
医疗器械经营许可证/备案 |
医疗器械销售资质 |
|
|
4 |
临床基因扩增检验实验室设置批复 |
临床基因扩增检验实验室设置申请 |
《医疗机构临床基因扩增管理办法》 |
|
5 |
高通量基因测序技术临床应用试点单位 |
医疗结构申请开展开展高通量基因测序技术试点 |
《关于开展高通量基因测序技术临床应用试点单位申报工作的通知》 |
|
6 |
医疗机构执业许可证 |
医疗机构经营资质 |
《医疗机构管理条例》、《医疗机构管理条例实施细则》 |
|
7 |
个人执业资格证 |
医疗机构专业人员个人从业资质 |
IPO审核中审核机构对于业务资质问题也是重点关注,常见的问询要点有:
• 发行人是否具备生产经营所需的全部资质,取得过程是否合规,产品是否取得批文;
• 披露发行人拥有的境内外资质、许可、认证证书的具体内容、有效期限、许可范围,相关资质是否到期或即将到期,续期是否存在障碍;
• 发行人的销售渠道(经销商)及客户是否取得相应资质等(包括:使用发行人产品的医生、医院是否具备相应资质);
• 是否存在涉及经营资质的行政处罚。
基于IVD行业的强监管特性,企业缺失基本的生产许可证、经营许可证、产品注册/备案的情况并不多见,业务资质方面建议企业重点关注的事项包括:①避免在未取得相应行政许可的情况下提前开展建设实验室、提供检验服务等需要行政许可的经营行为,以免受到行政处罚;②注意经销商模式下终端客户的管理及信息搜集工作,为IPO反馈阶段时的穿透披露提前准备。相关案例如下:
(1)企业设置的检验实验室/检验所或从事此类行为的子公司/分支机构,是否取得《医疗机构执业许可证》、《临床基因扩增检验实验室设置批复》、《临床基因扩增检验实验室验收合格证书》、《临床基因扩增检验实验室技术验收合格通知》、《高通量基因测序技术临床应用试点资格》以及其它地方行政执业许可等经营资质;该等机构设置于境外的,是否具有当地法律规定的从事上述业务的资质或权利能力。(华大基因300676.SZ)
(2)终端客户情况及其是否具备相应医疗资质,如:发行人的医用产品分为I、II、III级,II、III级以上严禁向非医疗机构销售……对于II、III级以上的各类医疗产品,区分民营医院、公立医院和经销商,说明相关产品的最终销售金额和主要客户;说明相关民营医院是否具有相关医疗资质。(华熙生物688363.SH,昊海生科688366.SH)。
2. 业务模式
对于医疗器械行业的发行人,在业务模式方面受到审核机构关注的要点包括:
• 发行人的销售模式,经销商及客户情况,与业务是否匹配;
• 发行人的采购模式,供应商情况;
• 发行人与经销商、供应商合作模式的合理性和必要性,定价是否公允,是否存在关联关系;
• 发行人销售过程中是否涉及商业贿赂或不正当竞争行为;
• 发行人学术/业务推广费的会计核算和支出情况,相关活动的合法合规性,是否存在商业贿赂行为。
销售模式,一方面是梳理出企业销售的基本流程,让潜在投资者更加了解发行人;另一方面是销售模式可以和发行人的财务指标起到相互验证的作用。IVD企业通常都采取以经销为主,直销为辅的销售模式。从现有IVD企业上市案例来看,经销商资质及发行人对经销商的管理制度受到关注,而相关的信息披露亦需穿透至终端客户。
审核机构关注业务模式的另一个重要原因在于医药行业的商业贿赂问题,主要问询要点包括:①销售过程中是否存在商业贿赂、不正当竞争等违法违规情形;②销售费用的真实性和合理性问题;③发行人是否存在有效防范商业贿赂的内控制度。
除这些常规问题外,对于IVD行业,常见的“试剂+仪器”联动销售模式也经常会受到审核机构关注,要求发行人说明是否涉及商业贿赂*。相关案例如下:
(1)请详细说明发行人的业务模式,发行人是否存在“行业内企业较普遍的通过投放、租赁、低价销售等形式将体外诊断仪器提供给医疗机构或经销商,以此建立稳定的合作关系,带动体外诊断试剂的销售”的经营模式、发行人的检测服务与诊断试剂销售的关系、诊断试剂销售是否存在个人客户、诊断服务对象是否均为采购或使用发行人诊断试剂的客户。(艾德生物300685.SZ)
(2)关于“仪器+试剂”联动销售。请发行人说明联动销售是否构成捆绑销售,是否存在违反《反不正当竞争法》或者违反卫生部相关规定的情形,销售过程中是否存在医疗贿赂等情形。(硕世生物688399.SH)
*除商业贿赂外,对于投放仪器的管理控制和会计核算也是联动销售模式下需关注的要点。
3. 产品质量
IPO审核机构对于医疗器械企业产品质量方面的问询要点包括:
• 发行人的质量管理体系建设及执行情况;
• 是否因产品质量问题引起纠纷或诉讼、是否因产品质量问题受到主管机关处罚或调查;
• 产品质量事件对发行人生产经营的影响。
除产品质量本身相关的常规问题外,审核机构往往也会重点关注产品质量方面一些监管制度的执行情况,如产品追溯制度、飞行检查制度、召回制度等等,并要求发行人做出详细说明。相关案例如下:
(1)请发行人说明行业主管部门对公司产品全流程追溯的具体要求,公司相关追溯制度的建立及执行情况。(安必平,科创板预披露)
(2)请发行人补充披露:报告期内是否存在因发行人产品质量导致的产品召回、医疗事故纠纷、赔偿支出、诉讼或其他纠纷,如存在,请披露具体情况及对公司生产经营的影响。(迈瑞医疗300760.SZ)
4. 环保要求
对于涉及医疗器械制造的企业,是否存在环保方面的瑕疵也是IPO审核中的一个关键问题。环保事项涉及企业的多个方面,包括生产线的建设审批,生产过程中的排污许可,企业的环保内控制度建设以及是否受到环保处罚等,与此相关的常见反馈意见或问询问题如下:
(1)请补充披露公司生产经营中主要排放污染物及排放量、环保设施其处理能力及实际运行情况、报告期各年环保投入和相关费用支出情况、募投项目所采取的环保措施及相应的资金来源和金额、环保投入与排污量的匹配情况等,并请保荐机构、发行人律师结合以上情况对公司的生产经营和拟投资项目是否符合国家环境保护的有关规定、在建和拟建项目是否已通过环境影响评价发表核查意见。(普门科技688389.SH、浩欧博(科创板预披露))
(2)请发行人补充披露报告期内公司生产经营中主要污染物的排放量、环保设施的处理能力及实际运行情况、报告期内环保投入和相关费用支出情况、环保投入与排污量匹配情况,是否存在违法违规行为,是否受到相关行政处罚,是否属于重大违法行为。请保荐机构和发行人律师对上述事项发表明确核查意见。(爱朋医疗300753.SZ)
(二)知识产权
1. 核心技术情况
就IVD行业来说,尤其是在分子诊断领域,发行人的主打产品往往在所属领域具备较高的创新性,核心产品的单项营业收入占企业整体营业收入比例较大。因此,该类企业的知识产权问题会受到重点关注,关注点包括核心技术情况、委托研发/合作研发情况、知识产权纠纷等。
对于核心技术,审核机构关注的重点一般包括核心技术的应用情况、与主要产品的匹配情况、核心技术的来源、以及核心技术的独立性等。相关案例如下:
(1)核查发行人核心专利的来源以及构成,技术属于原始创新、集成创新或引进消化吸收再创新的情况;核查核心技术与已取得的专利及非专利技术的对应关系,以及在主营业务及产品或服务中的应用,并披露核心技术产品收入占营业收入的比例,对主营业务的影响;核查是否构成第三方依赖、是否影响发行人资产独立性,对公司持续盈利能力有无不利影响。(佰仁医疗688198.SH)
(2)说明发行人核心技术的来源及形成、发展过程;说明发行人现有各项专利、计算机软件著作权等知识产权是否涉及董事、监事、高级管理人员或其他核心人员在曾任职单位的职务成果,是否存在权属纠纷或潜在纠纷。(迈瑞医疗300760.SZ)
2. 委托研发、合作研发
委托研发、合作研发情况是审核机构对于技术属性行业的常规关注事项。技术合作在企业经营中普遍存在,如产学研合作、与关联方/下游客户进行合作研发等等。技术合作的具体情况可能影响到发行人的技术完整性,如主要产品涉及到技术合作的,企业独立经营能力亦可能受到质疑。
委托研发、合作研发的关注重点包括合作协议的各方面条款约定情况、是否对发行人核心竞争力造成不利影响、发行人是否存在第三方技术依赖的情形、是否存在利用关联方或非关联方职务发明的情形。相关案例如下:
(1)请发行人进一步说明:是否存在合作研发的情况;发行人核心技术对合作研发是否存在依赖,发行人持续经营能力是否依赖于合作研发或相关单位;合作研发事项是否存在纠纷或潜在纠纷。若存在合作研发,请发行人补充披露:合作研发的具体模式、合同签署、主要协议约定、研发主要项目、合作研发权利义务相关约定、费用承担与研发成果权利归属、目前已取得的研发成果等。(普门科技688389.SH)
(2)请发行人说明向关联方采购技术开发的具体内容、相关成果、在发行人业务体系中发挥的作用、对发行人研发独立性的影响。(华大基因300676.SZ,首次反馈)
(3)请发行人在招股说明书中披露其研发体系的建立、取得的成果以及与华大研究院等关联方在研究方向、研发投入、研究成果分布等方面的比较,进一步说明发行人是否具备独立于关联方的研发能力;请发行人说明自身是否拥有独立的研发体系,在研发方面是否对控股股东、实际控制人及其投资的其他主体存在依赖;控股股东、实际控制人及其投资的其他主体目前的研发状况,是否存在为发行人承担研发费用的情况。(华大基因300676.SZ,二次反馈)
3. 知识产权纠纷
鉴于知产产权对于IVD企业的重要性,审核机构关注发行人上述知识产权问题时,亦会关注相关的纠纷情况,包括是否存在纠纷、相关纠纷可能造成的影响、是否涉及发行人核心技术或核心产品等,且要求企业详细披露相关情况。对于存在涉诉案件的,具体案件信息亦需要详细披露,并会要求企业及中介机构对败诉风险进行分析。相关案例如下:
(1)补充说明发行人是否已拥有与生产经营相关的所有专利,专利权属是否存在瑕疵,使用上述专利是否合法合规,是否存在纠纷,如果存在,请披露纠纷的详细情况及对发行人持续经营的影响。(复旦张江,科创板预披露)
(2)发行人与其他合作研发方是否存在共享知识产权的情形,权属是否清晰,是否存在纠纷或者潜在纠纷,并说明对发行人业务的具体影响(浩欧博,科创板预披露)
(3)2015年12月,发行人子公司香港医学被起诉专利侵权;2016年5月,发行人子公司深圳临检、香港医学被起诉无创产前基因检测违约。请发行人说明涉诉的具体原因、赔偿金额、案件进展、发行人是否存在败诉风险、是否对生产经营造成重大影响、发行人的产品或服务是否存在安全隐患。(华大基因300676.SZ)