编者按
《国务院关于<支持北京深化国家服务业扩大开放综合示范区建设工作方案>的批复》于2023年11月18日下发后,健康医疗服务领域中关于“探索对干细胞与基因领域医药研发企业外籍及港澳台从业人员的股权激励方式。支持符合条件的医疗机构开展干细胞等临床试验。支持干细胞与基因研发国际合作。”的政策东风“一石激起千层浪”,干细胞的伦理特殊性、法律监管政策的变化与发展值得我们追本溯源的梳理,同时也期待对干细胞研究活动涉及的潜在挑战及法律风险进行提炼总结,为相关市场主体开展干细胞相关研究、商业化活动提供参考。
引言
干细胞产品、技术及其研究应用自其诞生伊始就因其来源、治疗机制和体内活性等较传统药物更为复杂[1]而充满挑战。从FDA三拒某公司治疗肌萎缩侧索硬化症(ALS)产品上市申请[2],到各国患者不远万里参加“干细胞旅游”[3]的现象,欧美明星“一夜回春”等趣闻、和近年的某地“基因编辑婴儿”案件[4],以及我国对干细胞监管体系从按药品管理到按医疗技术管理再回归药品的反复探索,都不难看出干细胞产品在研发难度、伦理挑战以及监管政策方面均存在其特殊性。2023年10月8日,国家药品监督管理局药品审评中心(“CDE”)发布《关于公开征求<人源干细胞产品非临床研究技术指导原则(征求意见稿)>意见的通知》,是继CDE于2023年6月发布《人源性干细胞及其衍生细胞治疗产品临床试验技术指导原则(试行)》后在干细胞领域的又一动作,既是加快落实《“十四五”生物经济发展规划》“发展基因诊疗、干细胞治疗、免疫细胞治疗等新技术”要求[5]的举措,亦是对干细胞产品缺乏相应的非临床研究与评价策略及明确监管标准[6]呼声的回应。以下为系列文章的上篇,将从干细胞的伦理特殊性谈起,回顾、梳理我国干细胞监管政策的变化与发展,阐明当前的监管体系。
一、探本穷源:从干细胞的特征探究其伦理特殊性
(一)干细胞的定义、特征及分类
干细胞指一类具有自我更新、多向分化潜能的细胞。[7]科学界、产业界、政界、患者组织等对干细胞抱有很高期望的原因在于,干细胞与其他细胞相比,有两个特征:第一,干细胞是未分化的细胞,在很长的一段时间内拥有自我更新的能力;第二,在一定条件下,它们可以被诱导分化成特定的细胞。[8]其作为重要的再生医学产品,可能应用到涉及人体几乎所有重要组织器官的修复及人类面临的许多医学难题的研究中,在细胞替代、组织修复、疾病治疗等方面具有巨大潜力。[9]
干细胞可以多个维度分类:
-
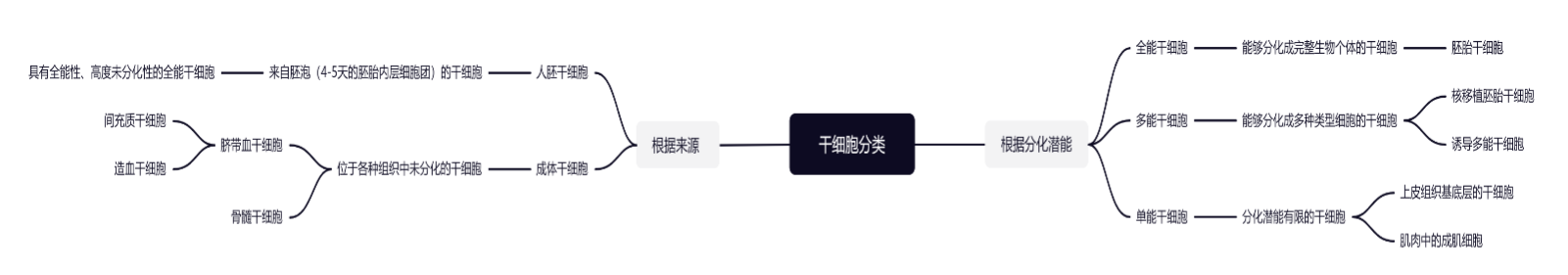
根据其分化潜能,干细胞分为全能干细胞、多能干细胞和单能干细胞。全能干细胞(Totipotent Stem Cells)是能够分化成完整生物个体的干细胞,例如人胚干细胞就是一种可以自我更新、高度增值的全能干细胞;多能干细胞(Pluripotent Stem Cells)是能够分化成多种类型细胞的干细胞,其包括核移植(Somatic cell nuclear transfer,SCNT)胚胎干细胞、诱导多能干细胞(Induced pluripotent stem cells,iPSC)等;单能干细胞(Unipotent Stem Cells)的分化潜能有限,包括上皮组织基底层的干细胞、肌肉中的成肌细胞等。[10]
-
根据来源,干细胞主要分为人胚干细胞和成体干细胞。人胚干细胞(Embryonic Stem Cells)是来自胚泡,即4-5天的胚胎(blastocyst)内层细胞团(inner cell mass)的一组细胞,如前述,是一种具有全能性、高度未分化性的全能干细胞,能分化出成体动物的所有组织和器官,包括生殖细胞。[11]成体干细胞(Somatic Stem Cells)是位于各种组织中未分化的干细胞,在一定条件下,可以分化成各种特异的细胞类型,其相对更容易获取,目前运用最多的两类成体干细胞包括脐带血干细胞(主要包含间充质干细胞、造血干细胞)以及骨髓干细胞。[12]
一些国家采取依据不同干细胞产品的性质而划分不同的风险等级进行管理的方式。以日本为例,其将细胞和基因治疗产品划为高、中、低三个风险等级。一级高风险产品包括未在人体使用过的诱导多能干细胞、人胚干细胞等;二级中风险产品包括已在人体使用过的自体间充质干细胞等;三级低风险产品包括自体细胞肿瘤免疫治疗等。[13]我国卫健委虽于2019年发布了《生物医学新技术临床应用管理条例(征求意见稿)》,提出生物医学新技术临床研究实行分级管理,将干细胞技术列为高风险生物医学新技术,但该条例未生效实施;尽管2021年实施的上位法《生物安全法》明确将生物技术研究、开发活动分为高风险、中风险、低风险三类,但该风险分类标准及名录尚未完全落地,故我国干细胞研究的风险管理制度尚未得见细节。
(二)伦理挑战及合规要求
从上述干细胞的定义及分类不难看出,干细胞不同的来源和分化潜能,对应着其面临的不同问题和风险等级,且从相关技术本身或就能窥见伦理层面的天然特殊性。所以,了解干细胞相关伦理问题的症结并遵守适用国家的伦理规范政策要求至关重要。
1. 伦理挑战
干细胞研究需要使用人类胚胎,因此会引发道德争论。其核心问题是,人类胚胎是否是“人”、具有人的道德地位,何时成为“人”,是否可以为了研究目的破坏人类胚胎。我国于2003年颁布的《人胚胎干细胞研究伦理指导原则》(“《人胚干细胞伦理原则》”)规定,利用体外受精、体细胞核移植、单性复制技术或遗传修饰获得的囊胚,其体外培养期限自受精或核移植开始不得超过14天。[14]为什么是14天?这源于英国科学家Mary Warnock提出的14天界限论。[15]她认为,胚胎细胞自受精后的前13天是全能的,可以发育成不同类的细胞,但在第14天,原条(primitive streak)的出现将决定个体特征,故她建议,允许对受精后的14天内的胚胎进行研究,而应禁止14天(或原条出现孰早之日)[16]之后的胚胎研究。这一建议尽管亦引发了诸多争议,但相继为英国立法机关、国际干细胞研究协会(International Society for Stem Cell Research,ISSCR)所采纳。我国也采纳了这一界限,不仅在《人胚干细胞伦理原则》中体现,且这一界限也将影响干细胞相关专利的授权(详见下文)。
另一种方式是通过前述体细胞核移植(SCNT)技术制造胚胎,即将供体细胞移入去核的卵母细胞中,经过体外培养等过程形成人胚胎干细胞。而通过该技术制造胚胎需要大量的人类卵子,鉴于女性体内所产生的卵子数量是有限的,且取卵的过程无疑是对女性身体的伤害且存在风险。为解决这一问题,科学家进行的尝试包括,在使用SCNT技术的过程中,用动物卵子取代人类卵子,从中提取人-动物细胞质杂合胚胎(human-animal-derived hybrid embryos)[17],这一跨越了物种界限的做法当然地受到了反对者的质疑,认为其侵犯了人类尊严。我国干细胞伦理规范也禁止这一做法[18];另一尝试使细胞重编程,使终末分化成熟的细胞变回为多潜能的原始干细胞,实现了成熟细胞的“返老还童”,赢得了2012年的诺贝尔(生理学或)医学奖[19],通过重编程方法将逆转录病毒递送至小鼠体细胞获得了具有类似胚胎干细胞特性的诱导多能干细胞(iPSC),这种方法由于原材料为从病人自身获得的成体细胞,产生社会伦理道德方面的风险较低,但另一方面,在iPSC诱导过程中使用的转录因及病毒插入都可导致肿瘤产生,而且未分化的iPSC可在体内形成畸胎瘤,这些都对iPSC的临床应用带来技术层面的挑战。[20]
2. 我国干细胞伦理监管要求
我国在21世纪初期即对干细胞研究领域引入伦理审查制度。自《人胚干细胞伦理原则》(2003)以来,原卫生部、原卫计委、原食品药品监管总局、卫健委、科技部、国家中医药管理局等部门相继出台了《涉及人的生物医学研究伦理审查办法(试行)》(2007)、《干细胞临床研究管理办法(试行)》(2015)、《涉及人的生物医学研究伦理审查办法》(“《2016伦理审查办法》”)、《涉及人的生命科学和医学研究伦理审查办法》(“《2023伦理审查办法》”)以及《科技伦理审查办法(试行)》(将于2023年12月1日生效)一系列法规文件,以及包括《涉及人的临床研究伦理审查委员会建设指南(2019、2020版)》(附则六 干细胞临床研究伦理审查)、《干细胞通用标准》(2020)、《人干细胞研究伦理审查技术规范》(2022)在内的行业规范及团体标准,逐步部署、细化了生命科学领域伦理审查的要求,亦有专门的法规或指导原则明确干细胞研究的伦理监管。
(1)组织内部伦理审查机构的要求
2003年出台的《人胚干细胞伦理原则》已对干细胞研究单位应当成立伦理委员会提出了要求,此后的法规在此框架基础上从以下角度对伦理委员会的设置和组成提出了要求,综合上述涉及伦理审查的法规看:
a)应当设置伦理委员会的主体:《人胚干细胞伦理原则》规定,从事人胚胎干细胞的研究单位应成立伦理委员会,该范围宽于《2016伦理审查办法》《2023伦理审查办法》下规定的伦理审查管理责任主体。[21]理论上来说,从事人胚胎干细胞研究的医疗卫生机构、高等学校、科研院所及企业均应成立伦理委员会。
b)伦理委员会的人数:对临床研究机构而言,不少于7人。[22]
c)伦理委员会的组织架构:法律法规未就医疗卫生机构已有的伦理委员会能否兼为干细胞伦理委员会作强制性规定,仅规定伦理委员会应对干细胞临床研究项目进行独立伦理审查;而《涉及人的临床研究伦理审查委员会建设指南(2020版)》[23]附则六《干细胞临床研究伦理审查》规定,国家批准的干细胞研究备案机构必须建立专门的干细胞研究学术委员会和干细胞研究伦理审查委员会。[24]实践中,医院设置干细胞临床研究伦理委员会/专委会会作为该院伦理委员会的分会或下设机构,对干细胞临床研究项目进行独立伦理审查。[25]
d)委员的背景要求:对于非临床研究机构的主体所设立的干细胞伦理委员会,应当包括生物学、医学、法律或社会学背景的专家[26];对于临床研究机构,还应包括伦理学、管理学及至少一位非专业的社会人士。[27]
从事干细胞研究的相关主体还应关注其是否应符合将于2023年12月31日施行的《科技伦理审查办法(试行)》的要求。该办法要求研究内容涉及科技伦理敏感领域的单位设立科技伦理(审查)委员会,[28]但同时规定,相关行业主管部门对本领域科技伦理(审查)委员会设立或科技伦理审查有特殊规定且符合本办法精神的,从其规定。[29]由于“符合本法精神”的标准并非完全清晰,对于已经设置医学伦理委员会或干细胞伦理委员会的主体,是否还需另行设置科技伦理(审查)委员会,有待在实践中进一步观察。如需设置,科技伦理审查与医学伦理审查、干细胞伦理审查委员会在符合相应法规的基础上,能否使用同一套班子,亦有待明确。
(2)伦理审查原则及重点
《涉及人的临床研究伦理审查委员会建设指南(2020版)》的附则六(“《伦理指南2020》”)专章明确了干细胞临床研究伦理审查的要求。《伦理指南2020》明确,干细胞临床研究除遵循通用伦理准则之外,还需要专门适用于干细胞临床研究的伦理要求。对于从事干细胞研究的主体而言,就伦理审查需关注以下要点:
-
机构资质合规性:申请或合作开展干细胞临床研究的机构应为已获得国家干细胞临床研究备案的机构[30],且机构应设置专门的干细胞研究学术委员会和干细胞研究伦理审查委员会。[31]
-
人体生物材料采集来源合规性:新采集的人体生物材料需由具备合法资格和资质的机构进行采集,用于干细胞研究的人体生物材料来源于生物样本库或供应商时,相关生物样本库或供应商应具有合法资格和资质。[32]注意人胚胎干细胞仅可通过以下方式获得:体外受精时多余的配子或囊胚、自然或自愿选择流产的胎儿细胞、体细胞核移植技术所获得的囊胚和单性分裂囊胚、自愿捐献的生殖细胞。[33]来源应便于回溯核实,审查时将通过相关材料转移协议、显示细胞系身份的数据,以及知情同意书等文件材料进行核实。[34]
-
贯彻知情同意原则:受试者有效的知情同意是必要的。对于缺乏自我决策能力的受试者,应该采用法定监护人代理同意。
-
不应通过伦理审查的研究内容:包括将人干细胞分化而来的生殖细胞用于生殖、将基于人干细胞构建的胚胎模型用于生殖、将人胚胎或生殖细胞进行基因改造后用于生殖、将非人灵长类全能干细胞、多能干细胞导入人胚胎的研究、将可能产生人生殖细胞的人-非人动物合体交配以繁殖后代、将人-非人动物嵌合胚胎移植到人或猿的子宫内以及其他严重违反社会公序良俗侵害动物福利或损害人类福祉的研究。[35]
-
跟踪审查:伦理审查委员会将根据研究的风险程度、研究周期决定年度/定期跟踪审查的频率,至少每年一次;其将审查经批准的研究方案的书面修改或澄清,以及已批准项目中的不依从/违背事件;且申办方和/或研究人员暂停/提前终止研究的申请、研究结题报告也将受到伦理委员会的审查。[36]
(3)违反伦理规定的后果
医疗卫生机构违反伦理原则的,将被责令停止干细胞临床研究工作并给予通报批评,并按科研不端行为记录,相关临床研究不得直接进入临床应用。[37]另外,《药物临床试验质量管理规范》(GCP)亦含伦理相关规定,而鉴于《干细胞临床研究管理办法(试行)》规定干细胞临床研究应当符合GCP的要求,相关主体违反伦理规定的还可能触发《药品管理法》下违反GCP的罚则,包括责令限期改正、警告、罚款、责令停产停业整顿、吊销执照等。[38]
二、千帆历尽:我国干细胞监管归口转换
我国干细胞监管路径在过去30年[39]间经历了折返往复的变化。在这段存在争议和不确定性的过程中,既有对干细胞应按“药品”还是“医疗技术”监管的探索,也与监管机构本身的发展重组和职权范围的变化密切相关。目前,干细胞产品按药品进行管理,干细胞临床研究备案管理制度也继续保留,形成了药监部门、卫生部门“双重监管”的管理体系。本节中,我们希望通过回顾产生这一系列变化的背景和原因,尝试理解干细胞相对特殊的监管背后的逻辑,并阐明当前监管路径下的重要要求,以期为读者更好地开展干细胞研究活动提供一定的参考。
(一)“药品”还是“医疗技术”:监管归口转变的历史沿革
干细胞临床研究的政策为何会经历不同阶段的演变?我国早自2001年[40]起,就通过“863计划”、“973计划”等战略性扶持政策在干细胞领域进行部署[41],故我国的干细胞研究已有多年历史,干细胞基础研究领域中科研论文与专利发表数量在国际上位于前列,但在法律规制体系、临床转化方面尚有脱节之处。[42]监管所面临的几个重要问题包括:谁来管、怎么管以及怎样的管理办法可以在解决未满足的临床需求,保证干细胞研究的规范性以及产品的安全性、有效性,以及维持、推动我国干细胞创新水平在国际的领先地位之间达到平衡。
我国干细胞监管的变化历程梳理如下:
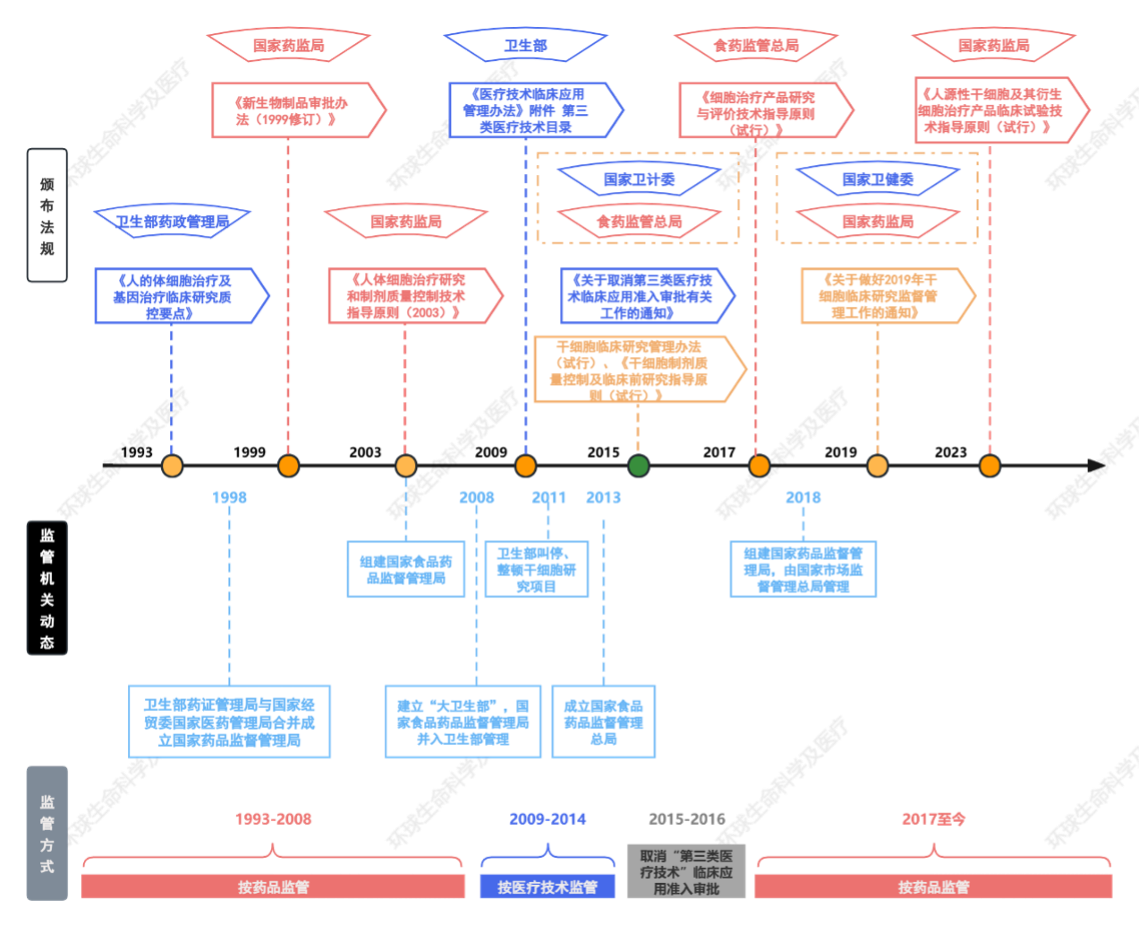
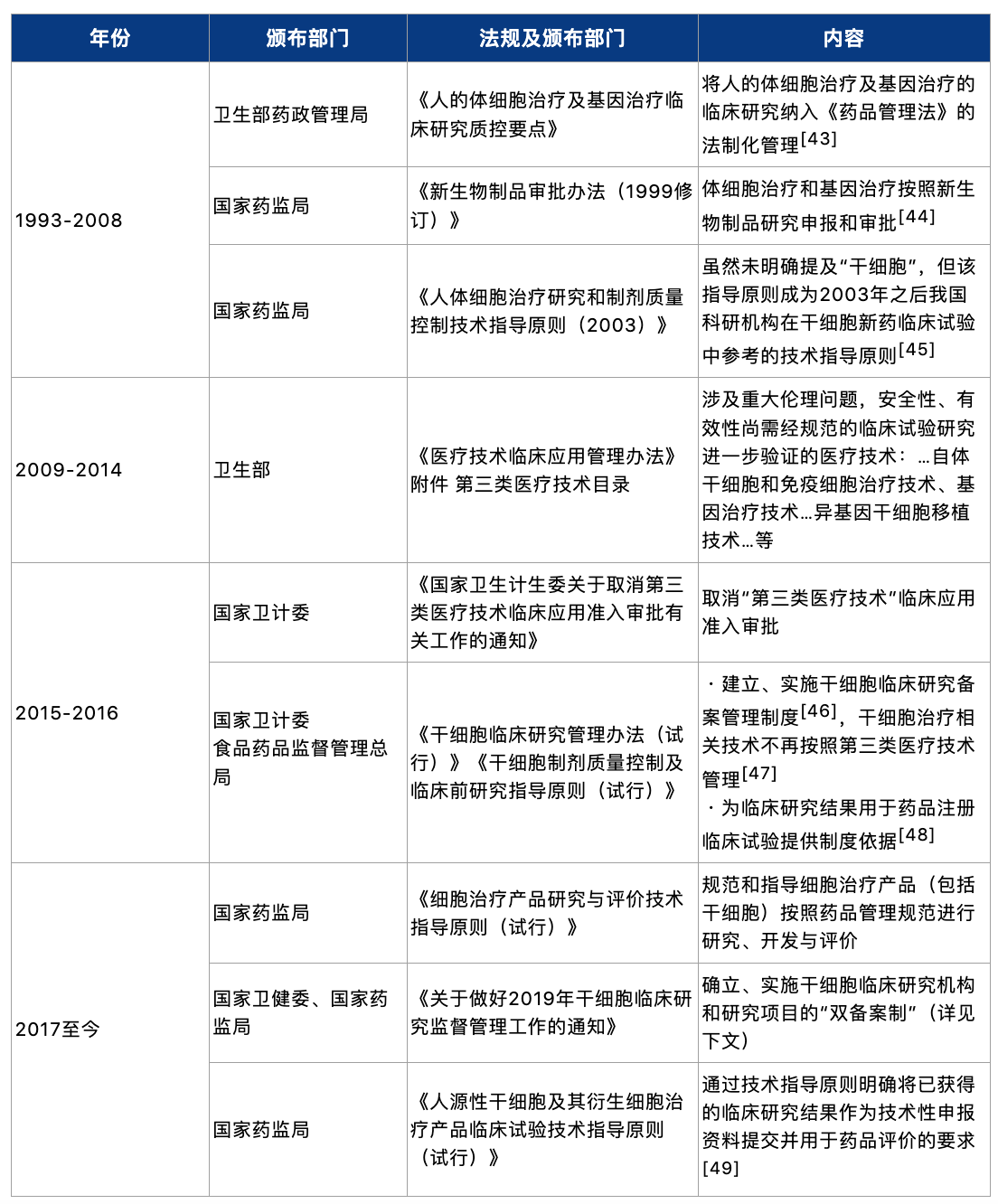
从以上变化过程中可见,干细胞研究很长一段时间是作为卫生部管理体系下的医疗卫生技术开展的,除监管机关本身的调整、整合因素外,这或许存在以下几方面原因:从新药研发的商业逻辑看,若干细胞产品没有明确的注册上市路径,则相关市场主体或缺乏按照新药注册临床路径开展研究、报批的动力;从实操角度看,按照医疗技术实施的干细胞治疗在此前的监管空白下无须经过审批即可开展,相对“简便”;从产品本身性质及研发角度看,干细胞治疗是个体化的治疗,这将导致每一批次的产品严格来讲都不通用、都不相同[50],与传统药物的研发、制备相比干细胞产品面临着特别的挑战。尽管我国较其他发达国家相比在干细胞经费的投入及研究水平上尚存差距,但在干细胞移植临床应用上却处于领先地位[51],每年进行的造血干细胞移植超过10000例[52]——这也意味着此前干细胞治疗存在乱象与监管空白;而另一方面,如前文所述,监管亦需考虑该领域的创新发展速度问题。因此,备案制作为一种替代和过渡的方法,可以使研究者先通过临床研究验证产品基本的安全、有效、稳定性,抑制干细胞治疗的乱象,再引导研究者通过临床试验走新药注册审评审批的路径走向规范——从这一系列的监管思路中可见监管者之大局智慧。
(二)“双重监管”:临床研究“双备案”+临床试验
目前,我国形成了“双重监管”的干细胞监管体系:即,就归卫生部门监管的临床研究,相关临床研究机构及临床研究项目均进行备案后方可实施研究项目;就归药监部门监管的注册临床试验,按照临床试验默示许可制度向国家药品监督管理局药品审评中心申请注册临床试验,完成注册临床试验的探索性和确证性试验后,再提交上市申请。截至2023年3月,经国家两委局备案的干细胞临床医疗机构已逾100家[53]、备案的干细胞临床研究项目已有100余项[54];而截至目前CDE公开的干细胞受理的干细胞临床试验有88项,且公开资料显示,目前已有干细胞注册临床进入III期。[55]
1. 临床研究的要求
(1)临床研究机构备案的资质要求
就临床研究的备案,首先依据《干细胞临床研究管理办法(试行)》,备案的医疗机构须具备以下条件:[56]
-
资质与组织要求:
- 三级甲等医院,具有与所开展干细胞临床研究相应的诊疗科目
- 具备药物临床试验机构资格
- 具有与研究相适应的高水平专家组成的学术委员会和伦理委员会 -
综合研究能力:具有较强的医疗、教学和科研综合能力,且具有稳定合法的研究经费支持
-
质量控制和风险管理能力:
- 具备完整的干细胞质量控制条件、全面的干细胞临床研究质量管理体系和独立的干细胞临床研究质量保证部门;建立干细胞制剂质量受权人制度;具有完整的干细胞制剂制备和临床研究全过程质量管理及风险控制程序和相关文件;具有干细胞临床研究审计体系,包括具备资质的内审人员和内审、外审制度
- 干细胞项目负责人和制剂质量受权人由机构主要负责人正式授权,具有正高级专业技术职称,具有良好的科研信誉。主要研究人员经过药物临床试验质量管理规范(GCP)培训,并获得相应资质。机构应当配置充足的具备资质的人力资源进行相应的干细胞临床研究,制定并实施干细胞临床研究人员培训计划,并对培训效果进行监测
- 具有防范干细胞临床研究风险的管理机制和处理不良反应、不良事件的措施
此外,干细胞临床研究应符合《药物临床试验质量管理规范》(GCP)的要求,干细胞制剂符合《干细胞制剂质量控制及临床前研究指导原则(试行)》的要求,其制备应符合《药品生产质量管理规范》(GMP)的要求[57];机构不得向受试者收取干细胞临床研究相关费用,不得发布或变相发布干细胞临床研究广告。[58]
(2)“双备案”制与医疗机构的痛点
“双备案”是指干细胞临床研究机构的备案与临床研究项目备案的组合,其实质是为了激励干细胞临床研究项目的申请:自双备案制度出台后,临床机构对干细胞临床研究的积极性并不高,而要求同步备案研究项目则意味着新的临床机构想获得机构的备案须带着项目一起申报,这就要求医疗机构需有实际研究项目方能申请获得备案资质。而许多医疗机构无法完成干细胞临床研究备案项目,这或许受制于医疗机构对干细胞制剂的质量控制能力、医疗机构的质量管理与风险防控体系建设情况以及相关研究人员对干细胞的了解与受培训程度。[59]
2. 临床试验及非临床研究的指导原则
自干细胞恢复按药品管理以来,CDE自2017年逐步恢复受理干细胞药物临床试验申请,干细胞药品将按药物注册申报上市的路径进行研发、注册和上市。如上文所述,干细胞临床研究在过往存在过“乱象”,研究的规范性也一直受到关注。2015年国家卫计委、食药监总局发布的《干细胞临床研究管理办法(试行)》和《干细胞制剂质量控制及临床前研究指导原则(试行)》,为干细胞临床研究的规范开展奠定了政策基础。[60]2017年发布的《细胞治疗产品研究与评价技术指导原则(试行)》,对细胞治疗产品按照药品管理相关法律法规进行研发时的技术要求进行了总体阐述[61],亦为企业后续按照药品注册路径申报临床所涉及的研究活动提供了政策依据。监管机关此后陆续收到多个申请人的干细胞相关品种的临床试验申请或沟通交流[62],在科学引导干细胞产品研发具有迫切性和急需性的背景下[63],CDE在历时数年[64]的起草和修订后,于2023年于4月、6月、10月分别发布了《人源干细胞产品药学研究与评价技术指导原则(试行)》《人源性干细胞及其衍生细胞治疗产品临床试验技术指导原则(试行)》《人源干细胞产品非临床研究技术指导原则(征求意见稿)》,足见监管探索、建立干细胞产品监管标准之成效,也为企业提供了可遵循的指引。
除此之外,在干细胞标准建设方面,我国业已积累了多年的探索经验。2017年,中国细胞生物学学会标准工作委员会就研究制定了我国首个干细胞团体标准《干细胞通用要求》;2022年,我国牵头与多国专家共同制定了干细胞国际标准ISO 24603《人和小鼠多能干细胞通用要求》;2023年9月,我国首部人源干细胞国家标准《生物样本库多能干细胞管理技术规范》(GB/T 42466-2023)发布,该规范主要规定了人多能干细胞和小鼠多能干细胞的相关术语定义、生物原材料的采集和接受、建系、复苏、培养、冷冻、存储、检测、分发和运输的管坪技术要求,适用于生物样本库中人和小鼠多能干细胞的研究与开发等。[65]这些标准及规范亦为市场主体开展干细胞的研发、制备等活动提供了指导。
值得一提的是,在“双重监管”的监管体系下,许多企业在申请注册性临床试验前,或已与医疗机构开展合作进行了临床研究的合作,而临床研究并不能代替按《药品管理法》《药品注册管理办法》等法规下为研发和注册申报而开展的[66]注册性临床试验,故相关企业势必关注临床研究结果如何用于药品注册审评[67]。对此,《人源性干细胞及其衍生细胞治疗产品临床试验技术指导原则(试行)》进行了专章规定,要点包括:[68]
-
若申请人向药品监督管理部门递交药物临床试验申请之前,已按管理办法要求开展了备案的干细胞临床研究,并拟用于药品注册申报,其应按照《生物制品注册分类及申报资料要求》,提供备案临床研究中使用的干细胞相关产品的药学、非临床及临床研究相关信息,其中,临床研究报告应按照《ICH E3:临床研究报告的结构与内容》进行撰写并提交。
-
药品审评部门对备案临床研究结果进行技术评价的主要目的和评价标准与药物临床试验相同,即判断干细胞相关产品的安全性、有效性或体内增殖存活和代谢特性等是否达到临床研究的预期目标。如果申请人拟将备案临床研究数据用于支持药品注册,应基于取得的备案临床研究结果,制定后续研发规划或后续临床试验方案,明确研究目标、研究人群和研究方法等。
-
干细胞备案临床研究用于药品注册审评的必要条件包括:
a)工艺和质量一致性:若申请人在临床研究过程中变更了原材料、生产或制备工艺及质量标准等,应解释原因并对变更后产品进行质量可比性研究,并评估变更对产品安全性或有效性的影响;
b)临床研究的合规性和数据完整性:违反GCP、损害受试者利益,或未按《药物临床试验必备文件保存指导原则》等指导原则保存临床研究原始资料或文件,导致临床研究结果无法溯源,或申请人递交的备案临床研究报告缺乏临床研究的关键信息,导致难以对备案研究结果进行评价时,干细胞备案临床研究结果不能作为干细胞相关产品注册申报的支持性证据。
从比较视角观察,我国的“双重监管”与国际上其他的监管制度(例如日本的“双轨制”)有所不同。我国当前两条监管路径下,走临床试验路径的药品注册申报具有明确的应用路径,而鉴于干细胞技术不再按医疗技术管理,临床研究缺乏明确的转化应用的路径,临床试验、临床研究目前并非同步并行的两条路径。日本亦对干细胞治疗技术和经注册性临床试验上市的干细胞产品分类管理,但不同点在于,(1)日本的干细胞临床治疗技术对应临床研究,经过安全性有效性评估的临床技术可在获得认证的医疗机构开展,应用路径明确;(2)日本的干细胞临床技术明确实施风险管理,根据风险分为I、II、III类,对于高风险(I类)临床研究的审查遵循更高的标准和更严谨的程序[69],而我国的干细胞产品风险管理体系仍有待进一步建设、落地。
针对干细胞研究活动涉及的潜在挑战及法律风险分析,敬请期待连载下篇合规关注要点内容。
注释:
[1] 国家药品监督管理局药品审评中心,《人源性干细胞及其衍生细胞治疗产品临床试验技术指导原则》,第一章第(一)节。
[2] BrainStorm eyes FDA meeting to find path for rejected ALS drug after withdrawing application, Oct 18, 2023, https://www.fiercebiotech.com/biotech/brainstorm-expects-meeting-fda-navigate-path-rejected-als-drug, 最后访问日期2023年10月24日。
[3] Kiatpongsan S, Sipp D. Medicine. Monitoring and regulating offshore stem cell clinics. Science. 2009 Mar 20;323(5921):1564-5. 陈秋,干细胞旅游——医院里的“干细胞旅游者”[J],世界博览,2011(21):30-32.
[4] 《国家卫健委、科技部、中国科协负责人回应“基因编辑婴儿”事件:已要求有关单位暂停相关人员的科研活动、对违法违规行为坚决予以查处》,http://www.xinhuanet.com/politics/2018-11/29/c_1123786707.htm,最后访问日期2023年10月24日。
[5] 国家发展改革委,《“十四五”生物经济发展规划》,第三章第(五)节。
[6] 国家药品监督管理局药品审评中心,《人源干细胞产品非临床研究技术指导原则(征求意见稿)》起草说明》,第一章。
[7] 国家药品监督管理局药品审评中心,《人源性干细胞及其衍生细胞治疗产品临床试验技术指导原则》,第一章第(一)节。
[8] 陈海丹,《干细胞治理:临床转化面临的挑战》(浙江大学出版社,2023),2。
[9] 国家药品监督管理局药品审评中心,《人源性干细胞及其衍生细胞治疗产品临床试验技术指导原则》,第一章第(一)节。
[10]中国细胞生物学学会杆细胞生物学分会,《干细胞通用要求》。
[11] 向静,《人类干细胞研究的法律规制与医学实践》(群众出版社,2016),4-5。
[12] 向静,《人类干细胞研究的法律规制与医学实践》(群众出版社,2016),6-7。
[13] 虞淦军,万涛,王闻雅等,《国际细胞和基因治疗制品监管比较及对我国的启示》,中国食品药品监管,2019.8(187):4-19。
[14] 《人胚胎干细胞研究伦理指导原则》,第六条(一)。
[15] 陈海丹,《干细胞治理:临床转化面临的挑战》(浙江大学出版社,2023),29,载“Hurlbut, J. B, Experiments in Democracy: Human Embryo Research and the Politics of Bioethics, Columbia University Press (2017)”。
[16] Human Fertilisation and Embryology Act 2008, Sections 4(3)(a)(b) (https://www.legislation.gov.uk/ukpga/2008/22/section/4).
[17] Williams, N., Plans for human–animal stem cells stalled. Current Biology Vol 17, No 3, PR72 (2007). https://doi.org/10.1016/j.cub.2007.01.035.
[18] 《人胚胎干细胞研究伦理指导原则》,第六条(二)。
[19] 中国科学院,逆转生命的时钟----2012年诺贝尔生理学或医学奖解读。https://www.cas.cn/zt/sszt/2012nobelprize/medicine/201210/t20121017_3659829.shtml ,最后访问日期2023年11月28日。
[20] 黄雷,张红梅等,病人特异性iPSC源性心肌细胞在长QT综合征发病机制中的研究进展,热带医学杂志,2012年11月第12卷第11期,1414、1416。
[21] 《2016办法》,第七条;《2023办法》,第五条。值得注意的是,根据卫健委的官方解读(https://www.gov.cn/zhengce/2023-02/28/content_5743660.htm,最后访问日期2023年10月26日),《2016办法》《2023办法》均为现行有效的法规。
[22] 《干细胞临床研究管理办法(试行)》,第八条。
[23] 本指南由国家卫生健康委医学伦理专家委员会办公室、中国医院协会联合发布。本指南系在国家卫生健康委员会领导和指导下,国家卫生健康委医学伦理专家委员会和中国医院协会牵头建立的我国的临床研究伦理审查委员会建设和评估指南,旨在通过第三方行业组织推动行业规范发展。
[24] 《涉及人的临床研究伦理审查委员会建设指南(2019版)》,附则六,第二章第(一)2条。
[25] 例如,中南大学湘雅医院医学伦理委员会下设的干细胞临床研究伦理分委员会(https://zndxyxrw.csu.edu.cn/yxll/zndxxyyyyxllwyh.htm,最后访问日期2023年10月26日);四川大学华西医院伦理办公室及其干细胞临床研究伦理审查专委会(http://www.wchscu.cn/scientific/clinical/department/55022.html,最后访问日期2023年10月26日);首都医科大学附属北京地坛医院伦理委员会及其干细胞临床研究伦理委员会分会(见《首都医科大学附属北京地坛医院伦理委员会章程》,https://www.bjdth.com/Html/News/Articles/6144.html#:~:text=%E5%B9%B2%E7%BB%86%E8%83%9E%E4%B8%B4%E5%BA%8A%E7%A0%94%E7%A9%B6%E4%BC%A6,%E7%A9%B6%E7%AC%A6%E5%90%88%E4%BC%A6%E7%90%86%E8%A7%84%E8%8C%83%E3%80%82,最后访问日期2023年10月26日)。
[26] 《干细胞伦理原则》,第九条。
[27] 《干细胞临床研究管理办法(试行)》,第八条。
[28] 《科技伦理审查办法(试行)》,第四条。
[29] 《科技伦理审查办法(试行)》,第五十四条。
[30] 《干细胞临床研究管理办法(试行)》,第十五条。
[31] 《涉及人的临床研究伦理审查委员会建设指南(2020版)》,附则六,第二(一)2条。
[32] 《人干细胞研究伦理审查技术规范》(2022),第5.1.1、5.1.2条。
[33] 《干细胞伦理原则》,第五条。
[34] 《人干细胞研究伦理审查技术规范》(2022),第5.1.1条。
[35] 《人干细胞研究伦理审查技术规范》(2022),第5.2.4条。
[36] 《人干细胞研究伦理审查技术规范》(2022),第6.2.1-6.2.5条。
[37] 《干细胞临床研究管理办法(试行)》,第五十条、五十一条。
[38] 《中华人民共和国药品管理法》,第一百二十六条。
[39] 1993年,原卫生部发布的《人的体细胞治疗及基因治疗临床研究质控要点》将细胞治疗纳入“药品”监管的范畴,迄今已约30年。
[40] 科技部,863计划“干细胞和组织工程”重大项目立项工作顺利完成(https://www.most.gov.cn/ztzl/863cj/863cjswny/200612/t20061229_39304.html,最后访问日期:2023年11月29日)。
[41] 国家卫生健康委,对十三届全国人大四次会议第7090号建议的答复,第一(二)节(http://www.nhc.gov.cn/wjw/jiany/202112/95d15354f601466893cfff3bfcbc6074.shtml,最后访问日期2023年11月16日)。
[42] 谈在祥,蒋雨彤,我国干细胞临床研究与应用的规制及监管研究[J],卫生经济研究,2021,38(7):33-37,43,33。
[43] 卫生部药政管理局关于下发《人的体细胞治疗及基因治疗临床研究质控要点》的通知,正文部分。
[44] 《新生物制品审批办法(1999修订)》,第十二条第4款。
[45] 陈海丹,《干细胞治理:临床转化面临的挑战》(浙江大学出版社,2023),62,载“耿洁,间充质干细胞制剂的质量控制//韩忠朝,李宗金,韩之波,间充质干细胞基础与临床(第二版),科学出版社,2018:23-24”。
[46] 《干细胞临床研究管理办法(试行)》,第四、十四、十五条。
[47] 《干细胞临床研究管理办法(试行)》,第五十五条。
[48] 《干细胞临床研究管理办法(试行)》,第五十三条。
[49] 《人源性干细胞及其衍生细胞治疗产品临床试验技术指导原则(试行)》,第四章。
[50] 陈海丹,《干细胞治理:临床转化面临的挑战》(浙江大学出版社,2023),65。
[51] 陈海丹,《干细胞治理:临床转化面临的挑战》(浙江大学出版社,2023),67。
[52] 中国造血干细胞移植的突破与成就(https://mp.weixin.qq.com/s/q0CeJ1TTF-rDd7CId8S_IA,最后访问日期2023年11月29日)。
[53] 健康界,最新!我国干细胞临床备案项目机构汇总(https://www.cn-healthcare.com/articlewm/20230109/content-1496136.html,最后访问日期:2023年11月30日)。
[54] 中国医药生物技术协会,干细胞临床研究研讨会第二轮通知。
[55] 受理号:CXSL1900016。
[56] 《干细胞临床研究管理办法(试行)》,第七条。
[57] 《干细胞临床研究管理办法(试行)》,第十七条。
[58] 《干细胞临床研究管理办法(试行)》,第六条。
[59] 何斌,赵庆辉,蒋尔鹏,等,双备案制度下干细胞临床研究角色职责的转变及应对策略[J],中华医学科研管理杂志,2021,34(3):4,174。
[60] 中国医药生物技术协会,干细胞制剂制备质量管理自律规范[J],中国医药生物技术,2016,11(6):481-490,481。
[61] 《人源性干细胞产品药学研究与评价技术指导原则(征求意见稿)》起草说明,1。
[62] 韩冬梅,何伍,韦薇,等,人源干细胞产品的药学评价考虑[J],中国新药杂志,2023,32(2):148-153,149。
[63] 见《人源干细胞产品非临床研究技术指导原则(征求意见稿)》,起草目的。
[64] 《人源性干细胞产品药学研究与评价技术指导原则(征求意见稿)》起草说明,1-2:2019年4月,CDE开启“细胞和基因治疗产品技术评价与监管体系工作”,2020年9月形成《干细胞产品药学研究与评价技术指导原则》初稿,2021年5月形成修订稿,2021年8月公开征求意见。
[65] 《科技日报》报社,我国首个人源干细胞国家标准发布[J],家庭医学,2023(20):4.
[66] 《人源性干细胞及其衍生细胞治疗产品临床试验技术指导原则(试行)》,2。
[67] 将干细胞临床研究结果用于后续药品注册性临床试验的法规基础为《干细胞临床研究管理办法(试行)》第五十三条:本办法不适用于已有规定的、未经体外处理的造血干细胞移植,以及按药品申报的干细胞临床试验。依据本办法开展干细胞临床研究后,如申请药品注册临床试验,可将已获得的临床研究结果作为技术性申报资料提交并用于药品评价。另外,我们注意到《人源性干细胞及其衍生细胞治疗产品临床试验技术指导原则》的征求意见稿中曾有一定条件下临床研究不需要重复开展临床试验的条款,后在试行稿中被删除——从该变化可以看出药监的审慎态度。
[68] 《人源性干细胞及其衍生细胞治疗产品临床试验技术指导原则(试行)》,16-18。
[69] Azuma, K. Regulatory Landscape of Regenerative Medicine in Japan. Curr Stem Cell Rep 1, 118–128 (2015)。
[70] 受理号:CXSL2200624。
[71] 《人类遗传资源管理条例实施细则》,第十二条。
[72] 受理号:JXSL1900126。
[73] 详见000989.SZ《关于并购基金的投资进展公告》,2019-004号。
[74] 《全面取消制造业领域外资准入限制,意味着什么》(https://www.thepaper.cn/newsDetail_forward_25009615,最后访问日期:2023年11月20日)
[75] 国务院关于《支持北京深化国家服务业扩大开放综合示范区建设工作方案》的批复(国函〔2023〕130号),附件,二(一)2。
[76] 《中华人民共和国专利法》,第5条第1款。
[77] 修改中与人体胚胎干细胞的相关规定主要涉及第二部分第一章第3.1.2节(违反社会公德的发明创造)和第二部分第十章第9.1.1节(依据专利法第5条对要求保护的客体的审查)。
[78] 国家知识产权局,2019年《专利审查指南》修改解读,第11点。
[79] 国家知识产权局知识产权发展研究中心,干细胞治疗技术研发布局进入高速发展期(https://mp.weixin.qq.com/s/JIJHRbv-YkFGKuwkXlchow,最后访问时间2023年11月29日)。
[80] 《中华人民共和国人类遗传资源管理条例》,第三条。
[81] 《中华人民共和国人类遗传资源管理条例》,第二条。
[82] 科技部,关于更新人类遗传资源行政许可事项服务指南、备案以及事先报告范围和程序的通知,《1.中国人类遗传资源采集行政许可事项服务指南》。
[83] 《人类遗传资源管理条例实施细则》,第二条。
[84] 《中华人民共和国人类遗传资源管理条例》,第七条。
[85] 《中华人民共和国人类遗传资源管理条例》,第二十一条。
[86] 《中华人民共和国人类遗传资源管理条例》,第二十七条。
[87] 《人类遗传资源管理常见问题解答》,第一条第3款。
[88] 《人类遗传资源管理常见问题解答》,第一条第2款。
[89] 国家市场监督管理总局,《关于加强干细胞广告监管的工作提示》,载于高原,“干细胞美容抗衰”广告宣传虚假违法,中国消费者报,2021年8月2日,第003版。
[90] Galipeau J, Sensébé L. Mesenchymal Stromal Cells: Clinical Challenges and Therapeutic Opportunities. Cell Stem Cell. 2018 Jun 1;22(6):824-833.