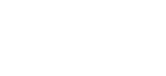引言
在即将过去的九月,A司重磅药物乌帕替尼的两件核心专利分别被国家知识产权局宣告全部无效和部分无效,这成为中国医药界最为关注的事件之一。根据中国国家知识产权局发出的第561725号《无效宣告请求审查决定书》,A司拥有的ZL201080062920.6号发明专利(化合物专利)被全部无效;在第562232号《无效宣告请求审查决定书》中,ZL201810902092.0号专利(组合物专利)被部分无效。两件专利无效宣告请求均由四川国为制药有限公司(“请求人”)提起。
需要明确的是,前述两份无效决定目前仍处于行政决定的可起诉期,无效决定尚未生效。
假设前述无效决定在行政诉讼程序中得以维持,那么该药物所涉细分领域的竞争格局将发生剧烈改变。乌帕替尼核心专利被无效这一结果也会让药企在研发和商业拓展(Business Development,“BD”)过程中更有动力去进行更周密、深入的知识产权布局和尽调。
本文以被全部无效的乌帕替尼化合物专利(以下简称’920专利)为切入点,对药企在研发和BD中的知识产权布局、尽调、管理的要点提出切实有效的建议。
一、乌帕替尼化合物专利无效情况简要介绍
(一)’920专利申请背景
根据’920专利的记载,乌帕替尼(Upadacitinib)的分子结构式为:
作为’920专利的最早优先权文件US61/265563(美国临时申请,申请日为2009年12月1日,以下简称“证据1”),该美国临时申请中并未记载这一结构式,而是重点研究了马库什结构式覆盖的系列化合物针对JAK3的抑制作用,因此该优先权文件中主要描述了该系列化合物抑制JAK3的实验数据,对于JAK1的抑制作用并没有明确提及,仅泛泛声称其对JAK家族中其他成员可能也有抑制作用。
A司从Y司分立后,其针对Y司的该最早优先权文本中披露的马库什结构式覆盖的分子进行了持续的研发,进而发现乌帕替尼结构分子对JAK1的抑制作用,且数据优异,体现出重大临床开发价值。
在该些研究成果的基础上,A司于 2010年12月1日递交了专利申请文件,同时要求证据1作为其最早优先权文件,该专利进入中国国家阶段的申请号为CN201080062920.6(即’920专利),该份专利在PCT国际检索阶段以及中国国家知识产权专利局实审检索阶段,均未检索出PX/PY类文献,按照《审查指南》的相关规定,在未检索到P类文件的情况下,审查员在审查过程中可以不核实相关专利申请的优先权,在此情形下,以最早优先权文本申请日作为现有技术的分界日,’920专利经过实质审查并在中国获得了授权。
(二)无效证据及理由简述
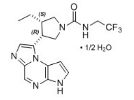
WO2009/152133A1是本案中的主要证据(以下简称“证据2”,最早优先权日为2008年6月10日,申请日为2009年6月9日,公开日为2009年12月17日,申请人为Y司),公开了结构式为
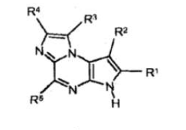
的马库什化合物,证据2还公开了下列具体化合物:
根据’920专利申请时适用的《审查指南》的规定,发明专利申请优先权成立的条件,除12个月的时间要求和未要求过优先权等程序性条件外,其还需满足的实质性条件是:在后申请与在先申请须是“相同主题”。所谓相同,并非要求在文字记载或者叙述方式上完全一致;而是正如《审查指南》所强调,如果在先申请对其技术方案中某一或者某些技术特征只作了笼统或者含糊的阐述,甚至仅仅只有暗示,而要求优先权的申请增加了对上述技术特征的详细叙述,以至于所属技术领域的技术人员认为该技术方案不能从在先申请中直接和毫无疑义地得出,则该在先申请不能作为在后申请要求优先权的基础。
请求人认为权利要求 1 的技术方案在优先权文件 US61/265563(证据 1)中没有记载,因此不应享有优先权,进而认为其相对于证据2不具备创造性。
将事实与法条对应,我们不难发现,乌帕替尼实际并未记载在其优先权文件中,其优先权难以成立,事实上,无效决定也支持了这一主张。在该优先权不成立的情形下,’920专利的优先权时间延后至第二优先权文件的申请日,即2010年7月14日,晚于证据2的公开日,这就为证据2用作对比文件评述’920专利创造性扫除了时间上的障碍。
再将目光拉回到’920专利的创造性问题上。证据2和A司专利的区别在于,证据2公开了覆盖乌帕替尼的马库什结构式,并未公开乌帕替尼的具体结构。国家知识产权局认为当权利要求保护的技术方案是具体化合物时,原则上应当将其以制备实施例和/或效果实施例的方式体现在说明书中,以使得本领域技术人员明确其在申请日前已经完成发明。对此,A司提交了补充试验数据,用于证明乌帕替尼针对JAK1的抑制效果。但国家知识产权局认为,该些数据从’920专利的公开文本中并不能得到,因此,对后提交的数据不予接受。A司还提出乌帕替尼取得了商业上的成功,以期克服无效请求人提出的缺乏创造性这一缺陷,但国家知识产权局认为,乌帕替尼在商业上取得的成功与发明的技术贡献之间并没有直接的因果关系,也不能由此反推发明的技术方案是显而易见的,从而使得发明具备创造性。
针对具体的创造性,无效决定认为:“’920专利仅在说明书第322页以表格形式记载了该化合物的名称、结构式、通用制备方法、保留时间Rf、质谱数据等与制备相关的信息,并未记载任何抑制活性的实验结果。因此,本领域技术人员能够直接毫无疑义地确定’920专利在申请日前制备获得了该化合物,但有关其效果,仍需借助本专利’920专利通式化合物和其他提供了实验结果的具体化合物进行结构分析,以使得本领域技术人员判断其是否具备JAK3激酶抑制活性。”简而言之,国家知识产权局认为’920专利的专利说明书未对请求保护的具体化合物分子进行充分公开,但公开是否充分是针对专利说明书的评价,如果以权利要求作为评价对象,其落脚点在于请求保护的化合物分子不具备创造性。
综上,乌帕替尼核心化合物专利由于缺乏创造性被宣告全部无效。
(三)对美国优先权制度的延伸探讨及中国国家知识产权局对补充实验数据的态度
前述乌帕替尼无效决定的逻辑起点在于A司的核心化合物不能享有优先权,那么,如果乌帕替尼分子化合物在美国遭遇无效挑战,其结局如何呢?
美国《Manual of Patent Examining Procedure》 (以下简称《MPEP》)关于优先权的规定如下[1]:
(A) 如果申请是一个或多个早期美国申请或国际申请的续案申请或分案申请,并且如果35 U.S.C. 120, 365(c)或386(c)的要求已经满足,则要求保护的发明的有效申请日期与续案申请或分案申请中的最早申请日期相同。
(B) 如果申请是早期美国申请或国际申请的部分续案申请,则新申请中的任何权利要求未被在先母案申请的说明书和权利要求所支持,其有效申请日期为新申请的实际申请日期。任何在35 U.S.C. 112下由早期在先母案申请完全支持的权利要求都具有该早期在先母案申请的有效提交日期。
(C) 如果新申请根据35 U.S.C. 119(e)要求临时申请的优先权,在临时申请中满足35 U.S.C. 112条款,即得到充分支持权利要求可以享有临时申请的申请日。
(D) 如果新申请根据35 U.S.C. 119(a)-(d)、365(a)或(b)或386(a)或(b)要求外国优先权,如果该权利要求在外国优先权文件中得到充分支持,则所要求的发明的有效申请日为外国优先权文件的申请日。
本文无意通过长篇累牍的撰写,对乌帕替尼核心化合物专利在美国法域内是否享有优先权进行讨论,本文列明的事实和法律规定主要为了说明:中美专利法实践中,对优先权是否成立的标准存在差异。中国在很长一段时间内主要采用绝对新颖性标准(近些年标准有所变化,笔者将在后续文章中进行详细探讨),美国采用了支持性标准。因此,如果乌帕替尼专利在美国遭遇专利无效,无效请求人可能需要选择其他路径以及进行更多的检索。
事实上,乌帕替尼核心化合物专利在欧洲也遭遇过异议程序,然而欧洲专利局接受了权利人补充的有关乌帕替尼选择性的实验数据,并在实验结果的基础上认定乌帕替尼相对于WO2009/152133A1具备创造性,维持了专利权有效。
综上,借乌帕替尼核心化合物专利无效案,中国国家知识产权局充分阐明了其针对化合物分子补充试验数据的态度:
-
在专利确权阶段,允许专利申请人在申请日或者优先权日之后提交补充试验数据并对该补充试验数据予以审查,但这并不意味着该补充试验数据当然可以被接受,对于补充实验数据的接受应当秉持相对审慎的态度,判断原则是“补交实验数据拟证明的待证和/或技术效果应当是所属技术领域的技术人员能够从专利申请公开的内容中得到的”;
- 针对化合物分子,其说明书应充分详实记载证明化合物功能的实验数据。
二、乌帕替尼专利被无效后对该领域竞争格局的影响
乌帕替尼是A司针对JAK1靶点开发的重磅药物。JAK( Janus kinase)是一类重要的非受体酪氨酸激酶家族,包括 JAK1、JAK2、JAK3、TYK2 四种亚型,上游为各类细胞因子的膜表面受体,下游为信号传导及转录激活蛋白( signal transducer and activator of transcription,STAT)。其信号通路的主要途径为:胞外细胞因子与受体结合后,激活与受体偶联的JAK,激活后的JAK通过酪氨酸残基自磷酸化进一步加强激酶活性后磷酸化下游STAT,活化后的 STAT形成二聚体、进入细胞核调控相应基因的转录过程。JAK-STAT 是胞内核心信号通路之一,广泛参与细胞的增殖、分化、凋亡等生理过程,并在免疫调节中发挥重要作用。
JAK分子家族是细胞信号通路的关键激酶和中心节点,JAK-STAT通路是细胞的核心通路之一,广泛参与细胞的增殖、分化、凋亡等过程,并在免疫调节过程中发挥重要作用,JAK 抑制剂具有巨大的市场应用空间。
2022 年 JAK 抑制剂市场规模已超 93.6 亿美元,获批适应症以自身免疫性疾病为主,截至2022年4月,国外已上市 JAK 抑制剂布局适应症列表如下[2] :
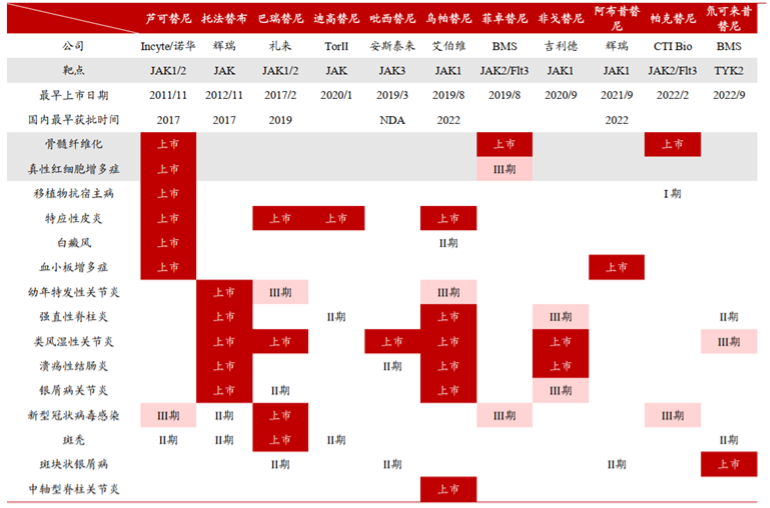
此外,众多药企还围绕JAK建立了大量管线,下图是围绕JAK靶点的前九大适应症及其对应临床研发阶段[3]。
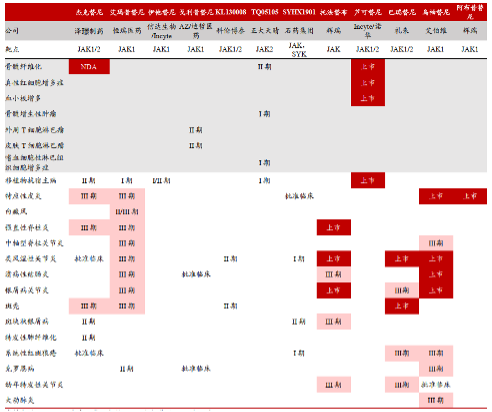
其中,截至2022年4月,国内在研JAK抑制剂适应症及临床进展也较为迅速,多家药企均进行了布局。
我们不难发现,A司的乌帕替尼无效决定一旦被法院维持,以JAK为靶点的特应性皮炎、强制性脊柱炎、类风湿性关节炎、溃疡性结肠炎、银屑病关节炎、中轴型脊柱关节炎治疗领域的竞争格局将被彻底改变。如果乌帕替尼核心化合物专利在行政诉讼阶段仍维持无效,基于前述分析的广阔市场,仿制药将以极低价格汹涌进入市场,同靶点同适应症的创新药将面临激烈的价格竞争,能否收回研发成本将成为相关药企需要重点考量的问题。
三、药企应对建议
药企的管线扩展和研发,通常通过三条路径来实现,一为自研,二为License -in,三为合作研发,无论是何种模式都可以从乌帕替尼无效案得到些许启示:知识产权(尤其是专利),应该在药企的管线扩展和研发过程中,承担越来越重要的角色,也值得药企倾斜更多资源。
(一)IP检索需贯穿自研管线从研发到市场化的全流程,应重视专利申请的撰写和布局
专利最大的魅力在于,其高度融合了技术和法律,并同时深深融入了产业发展,企业可基于专利壁垒创造巨额利润,进而改变行业格局,这一点在医药行业尤为明显。一件能够为企业带来竞争优势的和利润的高质量专利,一定是法律和技术的高度融合,仅依靠律师(或专利代理人)或仅依靠研发人员的技术交底书是无法撰写出高质量的、权利稳定的专利的。尽管大多数医药企业对研发,乃至专利挖掘和申请都极为重视,但对专利撰写本身的重要性还没有更深入的认识——重研发、重专利、轻专利撰写的企业在中国并不鲜见。
仍以优先权为例,除了前面讨论的成立要件外,优先权制度在本质上能够为企业延长一年的专利保护期,一个优秀的律师(或专利代理人)知道如何利用优先权制度为企业争取更多研发时间,为后续的产品销售争取额外的保护时间。
再以权利要求中的功能性技术特征为例,有研发人员对功能性技术特征的理解是该功能性技术特征涵盖了所有能够实现某一功能的特征,在此情形下包含功能性技术特征的权利要求相较于不含有功能性技术特征的权利要求保护范围更宽。事实果真如此么?在《专利法》司法解释中明确规定,权利要求解释中,对于纯功能性技术特征仅限于实施例列明的方式。在司法实践中,还有因功能性技术特征导致专利权的防御功能无法行使的情形。例如防电磁污染服专利侵权案中,权利要求的关键特征为“起屏蔽作用的金属网或膜由导磁率高而无剩磁的金属细丝或者金属粉末构成”,对此法院认为涉案专利说明书中既没有记载导磁率概念,又没有记载导磁率高的具体范围,该主张实际上是将能够实现防辐射目的的所有情形均纳入涉案专利权的保护范围,保护范围过于宽泛,亦缺乏事实和法律依据,据此驳回了专利权人的主张。在实践中,包含功能性技术特征的权利要求也更有可能遭遇专利无效的挑战。可见,专利仅停留在权利层面是无法为权利人带来应有的权利价值和经济价值的。
再以专利撰写前的检索为例。以申请日为界,申请日前的现有技术是随着律师(或专利代理人)的检索水平动态变化的,高水平的律师(或专利代理人)在查新检索后,能够锁定最接近的现有技术,除了为撰写专利申请文件提供支撑,还能为研发提供更多助力——了解行业整体专利布局和技术大体情况,为企业节约大量研发费用和试错成本。而单一思维的直线化检索,往往只见树木,不见森林,难以高质量地完成专利申请前检索。
重视各国专利法的相异点。通过PCT或巴黎公约途径进入各个不同法域的专利申请,应在PCT申请阶段即将各国的审查标准和要求融入到专利撰写中。为了完成这个目标,对重点法域专利申请、专利审查标准等的掌握成为必须。以第二部分作者阐述的中美专利法关于优先权成立标准的差异,我们不难发现,一个细节的不同往往可能决定一件专利在该法域的生死。
除了通过权利要求书的整体布局,构建对核心技术方案的层层包裹式保护,无效程序中、发起/应对诉讼时可能遇到的问题在专利撰写时也应该作为重要因素纳入考量。
专利代理价格的竞争在中国知识产权法律服务市场已近白热化:没有最低只有更低,如果说专利代理法律服务费用高不一定和高质量的专利代理服务划上等号,那么低价格甚至极低价格的专利代理法律服务费用一定无法支撑高质量的专利代理服务。在专利数量已经爆发式增长的今天,仅仅能够获得授权不应该成为企业知识产权布局追求的目标。获得授权只是前提和基础,能够经得起无效挑战、能够为核心产品在商业竞争中赢得时间和空间并构建护城河、能够为企业在处于竞争劣势时用知识产权赢得谈判筹码,才是企业知识产权布局的战略目标。这一目标的实现,需要切实有力的研发,也需要经验丰富的知识产权人,低价路线不可能实现前述战略目标。动辄千万级的研发投入,期望通过千元级的专利代理费用在知识产权层面上体现研发的价值,这本身就是值得深入思考的。
(二)知识产权尽职调查应成为BD交易过程的先行内容,并重点关注特殊类型专利及相关特殊规定
1. 知识产权尽职调查前置
药企在BD交易过程中,通常会进行知识产权尽职调查(IP尽调)。不同公司随交易进展情况,会在不同时间点进行IP尽调——有的公司会在评估管线数据、潜在市场规模、达成初步合作意向后,开始正式IP尽调;也有的公司会在接触到感兴趣的管线后第一时间进行初步尽调,伴随交易的深入,进行更加深入细致的IP尽调。笔者较为推荐第二种模式。理由如下:
-
专利是药品上市后最重要的护城河。由于中国暂无药品数据保护制度、孤儿药保护制度、儿童用药保护制度,因此,中国的创新药上市后,如没有专利保护,除头部药企能够通过强大的销售网络暂时维持竞争优势外,大多数企业均无法面对来自仿制药的残酷竞争。即使是头部药企,在仿制药企数量达到集采要求后,也将面临集采的价格压力。可见,专利是管线最重要的护城河,也几乎是唯一可以用于阻碍竞争对手进入相关市场的武器。
- 知识产权风险是BD交易中相对可控可评估的风险。药企的任何BD交易都面临大量商业风险,包括但不限于:市场规模评估错误、临床试验失败、临床试验进展不达预期、竞争对手临床进展超过预期、销售不达预期、市场渗透率不达预期、政策风险等,药企的BD交易在本质上是针对管线,在科学和商业层面进行预先判定和估值。坦率而言,这两种评估都极具挑战,风险不确定且不可控。虽然知识产权风险(如乌帕替尼被无效事件)也是BD交易过程中不得不面对的风险,但此类风险与商业风险、科学风险相比仍然相对可控,原因在于,专利法规是明晰的、保护范围是相对确定的、以申请日为界的现有技术也是相对明确的(随检索水平有一定差异)。哲学基本原理告诉我们,以相对确定且可控的前置条件得出的结论,较基于完全不可控不确定的前置条件得出的结论,要更加确定。
将待交易管线的专利事项前置,可以节约BD团队的大量时间和精力,且更容易得出是否继续推进的结论。
2. 关注管线涉及的特殊类型的专利
对于进入中国国家阶段通过分案申请(因单一性而分案的专利除外)、复审程序获得授权的专利,该专利申请在行政审查程序中往往因存有较大缺陷,需要通过特殊程序争取再次被审查的机会,进而通过修改权利要求缩小保护范围的方式,最终获得专利授权。经过特殊程序的专利,如果遭遇诉讼,根据《专利法》及相关司法解释的有关规定,行政审查程序中留下的所有审查相关文件,包括但不限于权利人的答复,申请人基于审查意见通知书进行的针对性的答复和修改,均有可能成为卷内证据,有可能对诉讼结果产生巨大影响,使得该种专利权无法达到护城河的作用。此外,在IP尽调过程中,对通过PCT途径或巴黎公约途径进入中国的专利申请,尤其要注意优先权的审核,中美两国关于专利权成立的实质条件存有较大差异,即使审查员在专利行政审查的过程中未检索出PX或PY类文件,也并不意味着该类专利由于优先权的存在而具有稳定性,优先权是否成立也应该成为知识产权尽调的重点之一,以避免出现乌帕替尼无效类似事件。
(三)对布局fast follow或me too管线的国内药企而言,应同时考量对标的头部跨国药企管线的专利稳定性
这项工作看似费时而无用,事实上,其对国内药企的研发和BD管线估值具有非凡的意义。对于fast follow或me too型研发而言,从本质而言,是国内药企对进口药物进行国产替代的过程,期待具备类似疗效的药物以更低价格与进口药物抢占国内相关市场。在BD财务模型中,通常会对管线的渗透率进行预估,该指标也会影响管线的销售预期以及销售达峰时间的评估和预期,这对BD标的的估值有重要参考价值。如果进口药物的专利是不稳定的,除非待评估或在研管线的药效明显优于进口药物,否则,仿制药将迅速占领市场,fast follow或me too型药物将很难为药企带来利润。
以乌帕替尼为例,如果法院最终维持了相关无效决定,在中国,JAK1相关药物市场的竞争格局及相关公司估值将被重塑。
此外,对于fast follow或me too对标的管线,药企在研发立项或评估license-in类似管线时,除关注其核心临床前实验数据、临床试验数据外,也应该重视其相应的副作用。仍以乌帕替尼为例,其在美国上市时被FDA标上了黑框警告,如其会增加病毒、细菌、真菌、结核等感染的机率,导致住院或死亡;对正在使用其他JAK抑制剂的病人,如果使用乌帕替尼,有可能提高全因死亡率等,具体如下[4]:

如果药企在研发立项或BD评估时,将上述副作用纳入考量,并进行相应的改进和提高,即使在乌帕替尼被无效的情形下,基于更小的副作用,CDE仍有可能基于能够让患者获益、在市场上造福更多患者的考量而考虑批准上市,为管线赢得生机。
创新是努力的方向,但任何创新都不会是无本之木、无源之水。创新离不开创新体制,也离不开创新人才,做best in class和first in class固然是令人欣喜的,但做me better可能是一条更务实的路径,只要充分利用好知识产权,改良型渐进式创新也是创新。
(四)合作研发的管线,IP事务应在联盟管理中居于重要位置
该部分所指的合作研发包括license-in或共同研发。药企在研发过程中,通常会对背景知识产权、前景知识产权、共同所有知识产权进行约定,关于知识产权的申报、无效应对、诉讼应对等也会有相关条款进行约定。前述安排均属必要,但并非充分。共同研发的管线,通常设有联盟管理,联盟管理在协调合作双方共同推进管线研发时,重点关注的内容通常包括管线相关的数据、临床试验方案的可行性与落地、技术与物料转移等,知识产权往往交由BD部门或法务部门处理。管线面临的知识产权风险是随着合作向前推进逐渐累积的,而联盟管理是合作研发过程中,与管线接触最多、最深入一线、最了解管线的职能部门。联盟管理如果能够借助内部或外部资源,将知识产权风险防范融入其日常工作,将对企业规避知识产权风险、扩充自身知识产权产生更加直接和高效的正向影响,例如借助法务部门或外部律所针对管线进行常态化的FTO检索、监视竞争管线的知识产权布局与动态、伴随管线进展执行BD合同、对合作开发合同中约定的知识产权条款尤其是前景知识产权条款进行梳理和约定。
四、结语
技术研发是医药企业的生命线,知识产权为医药企业的生命线筑起护城河,如何让这座城固若金汤、攻无不克,不仅要求企业法务和外部服务机构各司其职、协同作战, 还需要企业的业务、BD部门发挥市场引导作用,用创新引领市场、用专利为企业的市场价值保驾护航。
五、附记
国家知识产权局针对ZL201810902092.0作出的第562232号《无效宣告请求审查决定书》,虽维持了含有通式结构为
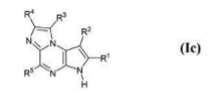
药物组合物专利,但明确宣告化合物AA1.160(即乌帕替尼)不在被维持有效的专利权范围内。
第562232号《无效宣告请求审查决定书》明确载明:“宣告201810902092.0”发明专利权的权利要求4中涉及化合物AA1.160的技术方案,以及权利要求11和12无效,在权利要求1-3、权利要求4除涉及化合物AA1.160的其他技术方案、权利要求5-10、13-20的基础上继续维持该专利有效。”
注释:
[1] https://www.uspto.gov/web/offices/pac/mpep/s2152.html
[2]不完全统计,图片来源于浙商证券研究院行业研究报告。
[3] 数据来源:智慧芽新药研发数据库。
[4] 信息来源:FDA官网。