近期,最高人民法院(“最高院”)在某侵害药品发明专利权纠纷案的上诉案((2021)最高法知民终388号)中,对上诉人撤回上诉的申请作出裁定,并在裁定书中主动审查了具有“药品专利反向支付协议”外观的专利和解协议是否涉嫌违反《反垄断法》。最高院经审理认定涉案和解协议不具有排除、限制竞争的作用,但法院探讨阐述了此类协议的一般审核标准。
反向支付协议最早是美国专利链接制度下的产物。最高院在我国专利链接制度施行之初即关注到此问题,并通过司法判例的形式作出指导,从宏观上说,体现了我国司法审判机关的前瞻性和高水平的审判能力,以及在知识产权强国建设纲要的指导下,结合中国实践、借鉴国际经验、打造国际一流知识产权司法审判中心的行动方针;从微观上说,在反垄断严监管、重处罚的形势下,该判例对我国境内原研药与仿制药企业的反垄断合规也具有重要指导意义。
一、案例相关摘要
最高院在裁定中指出,“药品专利反向支付协议”,是药品专利权利人承诺给予仿制药申请人直接或者间接的利益补偿,仿制药申请人承诺不挑战该药品相关专利权的有效性或者延迟进入该专利药品相关市场的协议。该类协议可能会产生排除、限制竞争的效果,有可能构成反垄断法规制的垄断协议。对于以不挑战专利权有效性为目的的“药品专利反向支付协议”是否涉嫌构成反垄断法规制的垄断协议的判断,核心在于其是否涉嫌排除、限制相关市场的竞争。对此,一般可以通过比较签订并履行有关协议的实际情形和未签订、未履行有关协议的假定情形,重点考察在仿制药申请人未撤回其无效宣告请求的情况下,药品相关专利权因该无效宣告请求归于无效的可能性,进而以此为基础分析对于相关市场而言有关协议是否以及在多大程度上造成了竞争损害。
最高院指出,仿制药申请人如未撤回其无效宣告请求,专利权因之归于无效的可能性是首要问题。原则上,专利权利人为使仿制药申请人撤回无效宣告请求,无正当理由给予高额利益补偿的,可以作为认定专利权因仿制药申请人提出的无效宣告请求归于无效的可能性较大的一个重要考量因素,同时一般还要对假定仿制药申请人未撤回其无效宣告请求情况下相关审查结果进行预测判断。有关协议的竞争损害,一般应当主要考察其是否实质延长了专利权利人的市场独占时间、是否实质延缓或者排除了实际的和潜在的仿制药申请人的市场进入。如果专利权因该无效宣告请求归于无效的可能性较小,那么有关协议的签订和履行对于相关市场上专利权人的市场独占和仿制药申请人的市场进入一般不会产生实质影响,进而可以初步认定其对于相关市场具有排除、限制竞争效果的可能性较小,一般不会构成反垄断法所规制的垄断协议。如果专利权因该无效宣告请求归于无效的可能性较大,那么应当进一步考察有关协议的竞争损害:如果有关协议的签订和履行实质延长了专利权利人的市场独占时间,或者实质延缓、排除了实际的和潜在的仿制药申请人的市场进入,且缺乏正当理由,则一般可以认定该协议具有排除、限制相关市场竞争的可能性较大,其涉嫌构成反垄断法所规制的垄断协议的风险也就更高。
简言之,最高院在该案中明确了两点。一方面,反向支付协议并不必然导致违反《反垄断法》;另一方面,考虑反向支付协议是否违反《反垄断法》,应该考虑如下因素:1. 药品相关专利权被归于无效的可能性;2. 是否实质性延长了专利权人的市场独占期或延缓了仿制药的市场进入,且缺乏正当理由。[1]
二、反向支付协议的前世今生
美国实践:
反向支付协议(reverse payment agreement, pay-for-delay agreement)作为原研药专利权人向仿制药申请人(潜在侵权方)支付金钱或给予其他利益、以换取仿制药放弃挑战专利、延迟仿制药上市所达成的专利和解协议,其最早是在美国1984年通过的《药品价格竞争与专利期补偿法》(Drug Price Competition and Patent Restoration Act,简称“Hatch-Waxman法案”)专利链接制度下所产生的。在Hatch-Waxman法案专利链接制度下,若首仿药申请人提出第四类声明(原研药相关专利无效或仿制药未落入相关专利权保护范围的声明),且原研药在规定的时间内(收到首仿药的告知书后的45天内)对首仿药提起专利侵权诉讼,原研药将获得30个月的专利侵权诉讼等待期,在此期间美国药监局(FDA)将暂缓批准仿制药的上市申请。此外,Hatch-Waxman法案为了鼓励仿制药对原研药发起专利挑战,给予首仿药180天的市场独占期。即便该首仿药与原研药因达成延迟上市协议而未能在此期间进入市场,FDA也不会在此期间批准其他仿制药的上市,其他仿制药也无法通过再次挑战专利享有市场独占期。
这种制度极大地鼓励了首仿药挑战原研药专利,也为原研药与首仿药达成和解共识制造了有利条件。首先,对首仿药而言,若专利挑战成功,其可以在180天的市场独占期内,以相对较高的仿制药价格上市,提前占领该药的仿制药市场,取得较大的市场份额和优势,弥补挑战原研药专利过程中所产生的诉讼成本。其次,对原研药而言,首仿药的180天市场独占期是其达成和解协议的重要动力之一,通过和解协议既可以将首仿药排除在市场竞争外,也可以避免其他仿制药对其专利进一步挑战。原因在于,对非首仿的其他仿制药而言,如果其不再能享受180天的市场独占期,即便挑战专利成功,也不具有明显竞争优势,无法避免其他各仿制药大量涌入并参与市场竞争。而考虑到专利诉讼高达几百万美金的诉讼成本和败诉风险,其他仿制药就不会有很大的动力通过挑战原研药的专利“为他人做嫁衣”;而且,在长达几年的诉讼周期内,原研药可能采取产品跳转(product hopping)等策略主动淘汰被挑战的药品,实现产品的更新换代,最终结局是,仿制药即便专利挑战成功,也可能只是“空欢喜一场”。
另外,Hatch-Waxman法案设置的30个月诉讼等待期,也给原研药变相拖延仿制药上市进程带来了便利。纵观美国现有的反向支付协议司法判例,原研药往往在30个月等待期即将到期时,迅速与首仿药达成和解,从而成功避免仿制药的上市。
Hatch-Waxman法案所遗留的这一潜在垄断问题,也逐渐引起了美国联邦贸易委员会(FTC)和美国司法部(DOJ)的关注。2003年,《医疗保险处方药、改进和现代化法案》(Medicare Prescription Drug, Improvement, And Modernization Act of 2003)对上述问题作出了部分回应,包括有条件地撤销首仿药的180天市场独占期,以及明确将原研药与仿制药之间达成的相关和解协议纳入FTC备案审查范围。
在随后若干年中,FTC以及各州对部分达成反向支付协议的原研和仿制药当事人提起了多起垄断诉讼,各联邦法院在审理过程中对反向支付协议的垄断审查标准出现了分歧。联邦第二、第十一巡回上诉法院认为专利法授予了原研药专利权人排除竞争的“合法垄断权”,采纳了“专利权权利范围”(scope of the patent test)的审查标准,即,当存在以下情形时,专利和解协议不违反反垄断法:(1)如果反向支付协议中仿制药延迟上市的时间在专利权人的专利到期日之前;(2)专利侵权诉讼并非毫无根据;(3)专利权的取得不存在欺诈等情形。
与之相反的是,联邦第三巡回上诉法院采纳了FTC所主张的 “快速审查原则”(quick look test),其认为此类协议可以推定违法,除非和解当事人能够证明:(1)其和解支付并非出于仿制药的延迟上市,而是基于其他考虑;(2)该和解协议是促进市场竞争的,而不是限制竞争。[2]
2013年,基于上述分歧,美国联邦最高法院在对FTC v. Actavis案[3]的审理中,以5:3的优势(Alito法官未参与投票)明确了反向支付协议可能产生限制竞争的效果,但不意味着其一定是限制竞争的,对此类案件应当适用“合理原则”(rule of reason)的审查标准,并指出,当原研药向仿制药给付巨大且不公平的利益(large and unjustified payment)时,提示可能存在垄断协议的风险。
合理原则的确定,意味着FTC或者是集体诉讼的原告需要承担举证责任,证明相关协议构成垄断,而美国最高院在此案中并没有给出更明确的指导。
在此后的几年中,原研药与仿制药的专利和解协议并未因此杜绝。据FTC的统计数据显示,2016年及2017年财政年间,因原研药与仿制药达成专利和解而在FTC登记的专利纠纷和解协议分别为232件[4]、226件[5]。就2017年的最新数据而言,未限制仿制药上市时间的和解协议达29件、限制仿制药上市时间但未提供价值转移的和解协议达169件、限制仿制药上市时间并可能提供补偿的和解协议有8件、限制仿制药上市时间并明确提供补偿的和解协议有20件。由此可见,明确或可能构成反向支付(限制仿制药上市且提供补偿)的和解协议占总专利和解协议的10%左右。
另外,为了规避反垄断审查,这些协议的条款设置也越来越隐蔽。而因反向支付协议垄断问题引发的集体诉讼案件层出不穷,各州以及联邦立法机关也试图通过立法来杜绝任何形式的反向支付协议。Actavis案之后,下级法院在审查反向支付协议时,对合理原则作出了进一步细化,包括何为“巨大且不公平的利益”的标准以及对专利诉讼可能结果的审查。部分法院认为,如果原研药向仿制药反向支付的金额超出了其节省下来的诉讼成本以及所换取的服务对价时,则为巨大且不公平的。[6]目前,大部分此类集体诉讼还处于未结诉讼阶段。
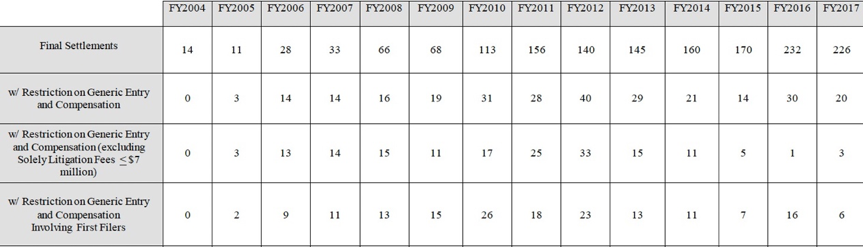
表:FTC统计的历年和解协议情况(来源:FTC网站)
欧盟动态:
欧盟虽然未建立专利链接制度,但欧盟委员会自2008年起关注到药品专利和解协议的垄断风险问题,并于2009年发布了其对医药行业专利和解协议的调查报告[7],且在随后几年发布了8份年度跟踪监测报告。欧盟委员会确立了2个判断反向支付协议是否违反欧盟竞争法的考量因素,即,①原研药企业是否限制仿制药企业进入市场,以及②是否向仿制药企业转移价值。
据2018年发布的最新监测报告统计,2016年欧盟成员国范围内的专利和解协议共107件[8](葡萄牙在2012年施行类似专利链接制度的相关法律后,专利和解协议的数量占比较高(42/107))。在这107件和解协议中,未限制仿制药上市时间的和解协议达29件、限制仿制药上市时间但未提供价值转移(value transfer)的和解协议达66件、限制仿制药上市时间并提供价值转移的和解协议有12件。因此,可能构成反向支付(限制仿制药上市且提供补偿)的和解协议占总专利和解协议约11%左右,与美国的数据统计结果趋同。
欧盟委员会在该2018年报告中指出,其政策并没有导致强行要求原研药与仿制药必须通过诉讼解决专利争议,事实上,自欧盟委员会开始监测以来,达成专利和解的总数是呈上升趋势的,而且欧盟委员会重点关注的是“限制仿制药上市时间并提供价值转移”的和解协议,其他89%的和解协议通过初步判断(prima facie)即可得出无需进一步反垄断审查的结论。在绝大多数的情况下,仿制药与原研药之间的和解协议都不存在反垄断法下的风险。
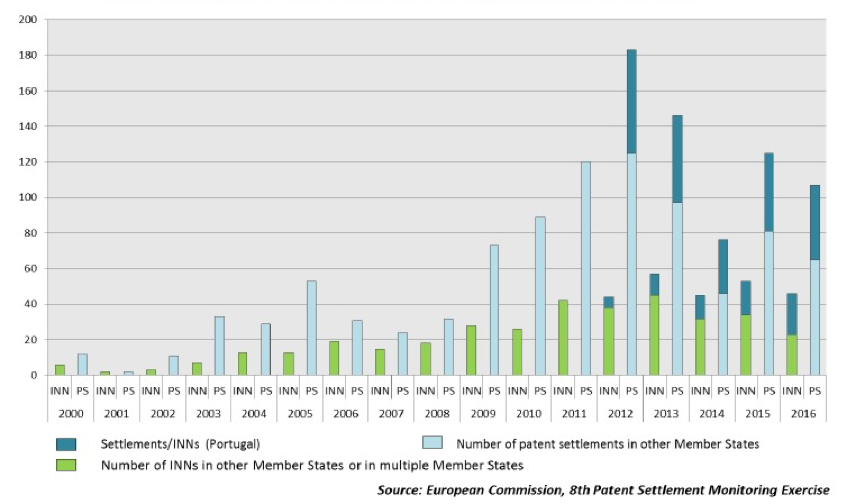
图:欧盟统计的历年专利和解协议情况(来源:欧盟委员会网站)
从司法审查角度,Lunbeck案是欧盟委员会针对反向支付协议处罚的第一案[9]。该案中,原研药与仿制药方于2002年达成专利和解协议,欧盟委员会于2010年启动调查,2013年作出处罚决定,对原研及仿制药企处以罚款共计约1.5亿欧元,认定涉案协议构成限制竞争协议,违反了《欧盟运行条约》第101(1)条。2016年,欧盟普通法院维持了欧盟委员会的处罚决定[10],对欧盟委员会确立的两个因素(①原研药企业是否限制仿制药企业进入市场,②是否向仿制药企业转移价值)予以认定,并指出此类反向支付和解协议的审查应当从协议本身的目的出发,结合协议条款内容、协议目标,及其签订的经济、法律背景具体分析。2020年,该案经上诉维持了原审判决。
综上,欧盟与美国的具体审查标准虽有所不同,但均考虑了仿制药上市时间的延迟以及原研药向仿制药的利益输送等情形。
此外,据公开媒体报道了解,近几年欧盟并没有出现太多的关于反向支付协议处罚的案例,一方面可能是相关主体充分意识到了此类协议的风险并积极避免;另一方面可能也说明反向支付协议在欧盟没有很大的市场适用空间,这可能与欧盟没有专利链接制度、各成员国药品定价机制和医保付费主体等制度设置有关。
三、反向支付协议的反垄断监管法律基础
目前,我国涉及滥用知识产权排除、限制竞争行为的主要监管依据为《中华人民共和国反垄断法》(“《反垄断法》”,2008年8月1日施行)、《禁止垄断协议暂行规定》(2019年9月1日施行)、《禁止滥用市场支配地位行为暂行规定》(2019年9月1日施行)以及《关于禁止滥用知识产权排除、限制竞争行为的规定》(2020年10月23日修订)。
《反垄断法》第十三条和第十五条对横向垄断协议作出了“禁止+豁免”的一般性规定,第十三条采用了列举的方式对不同类型的横向垄断协议进行归纳,反向支付协议可能涉及第十三条第三项“分割销售市场”、第四项“限制开发新产品”、第一项“固定商品价格”等。当然,不排除在某些情形下也可以适用《反垄断法》第十七条滥用市场支配地位相关条款。
另外,国家市场监督管理总局在《禁止垄断协议暂行规定》中也作出了进一步细化,第七至十二条列举了部分垄断协议行为,第十三条作为兜底,“不属于本规定第七条至第十二条所列情形的其他协议、决定或者协同行为,有证据证明排除、限制竞争的,应当认定为垄断协议并予以禁止。”该条同时指出,“前款规定的垄断协议由市场监管总局负责认定,认定时应当考虑下列因素:经营者达成、实施协议的事实;市场竞争状况;经营者在相关市场中的市场份额及其对市场的控制力;协议对商品价格、数量、质量等方面的影响;协议对市场进入、技术进步等方面的影响;协议对消费者、其他经营者的影响;与认定垄断协议有关的其他因素。”
国家市场监督管理总局在《关于禁止滥用知识产权排除、限制竞争行为的规定》(“禁止滥用知识产权的规定”)第四条指出,“经营者之间不得利用行使知识产权的方式达成《反垄断法》第十三条、第十四条所禁止的垄断协议。” 同时,该规定第十五条指出,“分析认定经营者涉嫌滥用知识产权排除、限制竞争行为,可以采取以下步骤:(一)确定经营者行使知识产权行为的性质和表现形式;(二)确定行使知识产权的经营者之间相互关系的性质;(三)界定行使知识产权所涉及的相关市场;(四)认定行使知识产权的经营者的市场地位;(五)分析经营者行使知识产权的行为对相关市场竞争的影响。”
四、反向支付协议的中国实践预测及企业合规启示
虽然反向支付协议这个概念来源于美国,而且是在专利链接制度下产生的,但正如上文所述,在没有专利链接制度的欧盟,反向支付协议也需要考虑垄断风险。由此可见,反向支付协议并不必然与专利链接制度有关,考虑其是否存在垄断风险,根本上需要从垄断视角考察。
尽管如此,专利链接制度下的反向支付协议的垄断风险更值得关注,部分原因在于:专利链接制度给予首仿药挑战成功的市场独占期。而市场独占期的设置初衷是基于公共利益,为了鼓励仿制药积极挑战原研药的专利、推进仿制药上市、争取平价药品的可及性。如果原研药与仿制药利用这个制度达成合谋,通过反向支付协议来划分市场,就超出了专利权人因专利制度所享有的“合法垄断权”范围,也不利于市场竞争和消费者利益。
而谈到我国的专利链接制度,总的来说,我们国家在建立专利链接制度之初,即考虑并规避了美国专利链接制度存在的诸多弊端,也降低了原研药与仿制药达成具有垄断风险的和解协议的可能性。
首先,依我们对相关规定的理解,首仿药若因与原研药达成和解未成功上市,其不会享有市场独占期,也不会击退其他仿制药的挑战积极性。我们国家对首仿药实行的是“双首个”标准,根据国家药监局、国家知识产权局发布的《药品专利纠纷早期解决机制实施办法(试行)》第十一条,“对首个挑战专利成功并首个获批上市的化学仿制药,给予市场独占期”。换言之,若原研药与首仿药达成和解,首仿药因未能上市不会享有市场独占期,也并不能阻止其他仿制药申请仿制上市。如此,原研药与首仿药达成和解的动力可能不足。需要指出的是,我国的“双首个”标准还存在模糊不清的问题,还需要较长一段时间的实践来确定一些基本标准,实践中也反映出了市场主体的犹豫。
其次,美国对化学药专利链接设置了30个月的诉讼等待期,而我国仅9个月。这一设计可能与我国司法和行政程序的效率相关,相对而言我国的专利行政程序和民事诉讼程序比美国更快,在此期间仿制药面临的原研药产品跳转的风险也相对较低。再考虑到中美专利诉讼的诉讼成本的巨大差异以及双方面临的诉讼风险,在美国,双方可能都有比较强烈的和解意愿,而在中国,仿制药因挑战专利而承担的诉讼成本相对较小,在某种程度上这也会影响双方的和解意愿。
此外,需要关注的是,在生物制药如火如荼发展的当下,我国目前的专利链接制度虽然规定了上市药品专利信息登记及公开的范围包括生物制品领域的活性成分的序列结构专利和医药用途专利,生物类似药(biosimilar)申请人也可以根据《药品专利纠纷早期解决机制实施办法(试行)》第六条作出四类声明,但《药品专利纠纷早期解决机制实施办法(试行)》并没有规定首个生物类似药的独占期,也没有为生物药的专利纠纷设置审批等待期。而美国则是在《生物制品价格竞争与创新法案》(Biologics Price Competition and Innovation Act , BPCIA)中,采取了与传统化药截然不同的专利链接制度——专利舞蹈(patent dance)。专利舞蹈制度并不要求生物原研药(biologics)公开其涉药专利,因此生物原研药与生物类似药生产商对涉药专利的争议解决的不透明度更高。而考虑到生物药相比传统化药的仿制难度、技术壁垒、所涉专利复杂性,以及生物类似药的价格优势不如传统化学仿制药明显等特点,可能在生物药领域的竞争态势与传统化学药具有很大差异,其反向支付协议的模式和发展趋势也会有所区别。
从上述分析来看,我国专利链接制度所导致的反向支付协议问题,可能不会在短期内出现井喷。但广义地讲,原研药与仿制药之间因专利挑战结局的不确定性或其他考量而达成的和解协议所引发的垄断风险,仍然非常值得关注。在目前我国反垄断严监管、重处罚的趋势下,同时考虑到反垄断执法机构的审查标准和思路与法院有所不同,在某些情形下反垄断执法机构可能会适用推定违法或快速审查原则,可以预期的是,药品行业反向支付协议问题在一定程度上也会引起执法机关的重视。原研药与仿制药在达成专利和解协议的过程中,也应当对协议本身做好反垄断合规自查,在现行法律法规的框架和司法判例的指导下,对协议条款和权益义务分配作出妥善处理,避免垄断风险。
注释:
[1] 从最高院裁定原文理解,最高院的审理思路与目前欧美法院的思路稍有不同,最高院更强调分析涉案专利归于无效的可能性。
[2] In re K-Dur, 686 F.3d 197, 214 (3d Cir. 2012), vacated, 133 S. Ct. 2849 (2013).
[3] FTC v. Actavis, Inc., 570 U.S. 136, 140, 133 S. Ct. 2223, 2227, 186 L. Ed. 2d 343 (2013)
[4] Then, now, and down the road: Trends in pharmaceutical patent settlements after FTC v. Actavis https://www.ftc.gov/news-events/blogs/competition-matters/2019/05/then-now-down-road-trends-pharmaceutical-patent (By Jamie Towey and Brad Albert, Bureau of Competition | May 28, 2019)
[5] https://www.ftc.gov/system/files/documents/reports/agreements-filed-federal-trade-commission-under-medicare-prescription-drug-improvement-modernization/mma_report_fy2017.pdf
[6] In re Opana Er Antritrust Litig., 162 F. Supp. 3d 704, 2016 U.S. Dist. LEXIS 16700, 2016-1 Trade Reg. Rep. (CCH) P79,505.
[7] https://ec.europa.eu/competition/sectors/pharmaceuticals/inquiry/index.html
[8] https://ec.europa.eu/competition/sectors/pharmaceuticals/inquiry/patent_settlements_report8_en.pdf
[9] 关于该案的背景介绍,可参考:1.欧盟竞争法历史上第一起专利和解反向支付案——灵北制药案https://mp.weixin.qq.com/s/vtZQ0UbjUmbDSY1h4a3s5Q ;2. 焦海洋,比较视角下药品专利反向支付和解协议违法性的认定研究[J], 科技与法律,2021(5):111。
[10] Lundbeck v Comm’n, Case T-472/13; Ranbaxy Labs. & Ranbaxy (UK) v. Comm’n, Case T-460/13.